题目内容
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
【答案】A
【解析】
由实验步骤及转化图可知,发生反应2Cu+O2+4HCl===2CuCl2+2H2O, N为Fe2+,M为Fe3+,在制得在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜,且化合物中正负化合价代数和为0,依此结合选项解答问题。
A.根据上述分析,N为Fe2+,M为Fe3+,A选项错误;
B.根据化合物中正负化合价的代数和为0,可知2a=b+c,B选项正确;
C.Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+形成Fe(OH)3而除去,从而达到除去Fe3+的目的,C选项正确;
D.根据方程式2Cu+O2+4HCl===2CuCl2+2H2O,若制备1 mol的CuCl2,理论上消耗0.5molO2,标况下,![]() ,D选项正确;
,D选项正确;
答案选A。

【题目】Ⅰ:用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为2 MnO4-+5H2C2O4+6H+ = 2Mn2++10CO2↑+8H2O。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化),实验装置如图甲所示:

实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
② | 20 mL 0.2 mol·L-1 H2C2O4溶液 | 30 mL 0.01 mol·L-1 KMnO4溶液 |
(1)该实验探究的是_________________________________因素对化学反应速率的影响。
(2)若实验①在2 min末收集了4.48 mL CO2(标准状况下),则在2 min末,c(MnO4-)=________ mol·L-1(假设混合溶液的体积为50 mL)。
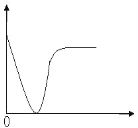
(3)小组同学发现反应速率变化如图乙,其中t1~t2时间内速率变快的主要原因可能是:
①产物Mn2+是反应的催化剂,②_______________________________
Ⅱ:当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)该反应的化学方程式为___________________________________
(2)在恒温恒容密闭容器中,判断上述反应达到平衡状态的依据是________________
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1