题目内容
【题目】利用阿伏加德罗定律及其推论,判断下列说法正确的说法是( )
A. 同温同压下两种气体的体积之比等于摩尔质量之比
B. 同温同压下两种气体的物质的量之比等于密度之比
C. 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比
D. 同温同体积下两种气体的物质的量之比等于压强之比
【答案】D
【解析】A. 同温同压下两种气体的体积之比等于其物质的量之比,A不正确;B. 同温同压下两种气体的物质的量之比等于其体积之比,也等于其分子数之比,B不正确;C. 同温同压下两种质量相同的气体其体积比之比与其摩尔质量之比成反比,C不正确;D. 同温同体积下两种气体的物质的量之比等于其压强之比,D正确。本题选D。

【题目】氢化钙(CaH2)是一种常用的储氢材料,也是登山运动员常用的能源提供剂,需要密封保存,遇水反应生成氢氧化钙和氢气。某研究性学习小组模拟生产企业制取氢化钙。
(实验)
用锌粒和稀硫酸反应制得干燥、纯净的氢气,再与金属钙在加热的条件下直接化合,即可制得CaH2。
(1)下列有关该实验的说法正确的是_____________________________________。
a.其他条件相同时,粗锌制取氢气的速率比纯锌快
b.加热时,必须通入氮气作为保护气,以防止空气的干扰
c.可以用浓硫酸或碱石灰对H2进行干燥除杂
d.开始实验时,应先通入H2,后给金属钙加热
e.停止实验时,应先停止通入H2,后停止加热
(提出假设)
(2)由于实验中操作不当,金属钙或氢化钙都可能被氧化;该小组甲同学对反应后的固体产物成分提出如下假设:
假设1:含有Ca和CaH2;
假设2:含有CaH2和CaO;
假设3:含有__________________。
(设计实验方案,验证假设)
(3)定性实验用化学方法鉴别Ca与CaH2,请设计实验完成下表中内容。
实验步骤 | 预期现象和结论 |
取少量固体样品,____________________________________________________________________。 | _______________________________________________。 |
(4)定量实验测定Ca和CaH2混合物中CaH2的质量分数。
①取m1 g样品与水完全反应,利用如图装置测定生成的气体体积时,在________时进行收集(填字母)。
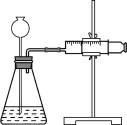
a.刚开始有气泡
b.气泡连续均匀
c.气体经过验纯后,再收集
②如果装置气密性良好,操作正确,乙同学认为:由于液体加入,导致气体的体积测定_____________(填“偏高”“偏低”或“无影响”),则计算出氢化钙的质量分数_____________(填“偏高”“偏低”或“无影响”)。
(反思与交流)
(5)登山运动员常用氢化钙作为能源提供剂,与氢气相比,其优点是氢化钙是固体,携带方便。既然金属钙与水反应也能生成氢气,为什么还要将金属钙制备成氢化钙呢?你的观点是_______________________________________________________________________________________________________________ 。