题目内容
下列叙述,正确的是
A.H2SO4的摩尔质量是98
B.等物质的量的O2和O3中所含的氧原子数相同
C.将98 g H2SO4溶解于500 mL水中,所得溶液中硫酸的物质的量浓度为2 mol/L
D.等质量的CO与CO2中所含碳原子数之比为11︰7
【答案】
D
【解析】
试题分析:摩尔质量的单位是g/mol,A项错误;等物质的量的O2和O3中所含的氧原子数之比是2:3,B项错误;将98 g H2SO4溶解于水中,所得溶液是500 mL,浓度为2 mol/L,C项错误;根据 ,等质量的CO与CO2中所含碳原子数之比等于其摩尔质量的反比,及44:28,D正确。
,等质量的CO与CO2中所含碳原子数之比等于其摩尔质量的反比,及44:28,D正确。
考点:考查物质的量、物质的量浓度的相关计算。
点评:属于较简单题。

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
下列叙述中正确的是( )
| A、胶体和溶液的本质区别在于能否发生丁达尔现象 | B、K3C60在熔融状态下能够导电,所以K3C60是电解质 | C、离子键的本质就是阴、阳离子之间的相互吸引 | D、变化过程中化学键被破坏,则一定发生化学变化 |
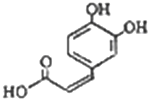 从蜂花属植物中提取到的酸性物质,其结构如图所示.下列叙述不正确的是( )
从蜂花属植物中提取到的酸性物质,其结构如图所示.下列叙述不正确的是( )| A、该分子式中的所有碳原子均可能在同一平面 | B、迷迭香酸可以发生加成、取代、显色反应 | C、1mol迷迭香酸跟H2反应,最多消耗5molH2 | D、1mol迷迭香酸与足量NaHCO3溶液反应,最多消耗1mol NaHCO3 |
相同温度下,体积均为0.5 L的两个恒容密闭容器中发生可逆反应:2XY2(g)+Y2(g)?2XY3(g)△H=-Q kJ?mol-1(Q>0)实验测得反应在起始、达到平衡时的有关数据如下表所示:
下列叙述不正确的是( )
| 容器 编号 |
起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| XY2 | Y2 | XY3 | ||
| ① | 2 | 1 | 0 | 放热 0.25 Q kJ |
| ② | 1.2 | 0.6 | 0.8 | |
A、容器①、②中反应的平衡常数均为
| ||
| B、达到平衡时,两个容器中Y2的物质的量浓度均为1.5 mol?L-1 | ||
| C、容器②中反应达到平衡时放出的热量为0.15 Q kJ | ||
| D、若容器①的其他条件不变,恒压下通入稀有气体,则达到平衡时放出的热量小于0.25 Q kJ |