题目内容
【题目】NA表示阿伏加德罗常数,下列叙述正确的是
A. 1mol/L Na2SO4溶液含有 2NA个Na+
B. 1.7g H2O2 中含有的电子数为0.9NA
C. 标准状况下,用H2O2制备11.2L 氧气共转移2NA个电子
D. 等质量的N2和CO所含分子数均为NA
【答案】B
【解析】A项,溶液的体积未知,无法计算Na+的物质的量,错误;B项,n(H2O2)=![]() =0.05mol,1个H2O2分子中含18个电子,1.7g H2O2 中含有的电子数为0.9NA,正确;C项,n(O2)=
=0.05mol,1个H2O2分子中含18个电子,1.7g H2O2 中含有的电子数为0.9NA,正确;C项,n(O2)=![]() =0.5mol,O元素的化合价部分由H2O2中的-1价升至O2中的0价,部分由H2O2中的-1价降至H2O中的-2价,则反应中转移电子NA,错误;D项,N2和CO的摩尔质量都是28g/mol,等质量的N2和CO物质的量相等,所含分子数相等,由于质量未知,无法确定分子数,错误;答案选B。
=0.5mol,O元素的化合价部分由H2O2中的-1价升至O2中的0价,部分由H2O2中的-1价降至H2O中的-2价,则反应中转移电子NA,错误;D项,N2和CO的摩尔质量都是28g/mol,等质量的N2和CO物质的量相等,所含分子数相等,由于质量未知,无法确定分子数,错误;答案选B。

 名校课堂系列答案
名校课堂系列答案【题目】胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为 Fe)来制备胆矾.有人设计了如下流程:
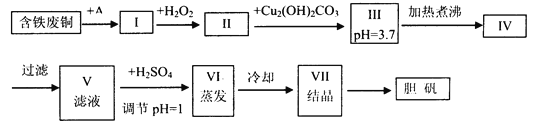
pH 值控制可参考下列数据
物质 | 开始沉淀时的 pH 值 | 完全沉淀时的 pH 值 |
氢氧化铁 | 2.7 | 3.7 |
氢氧化亚铁 | 7.6 | 9.6 |
氢氧化铜 | 5.2 | 6.4 |
请根据上述流程回答下列问题:
(1) A 可选用________(填字母).
a.稀 H2SO4 b.浓 H2SO4、加热 c.浓 FeCl3 溶液 d.浓 HNO3
(2) Ⅰ中加 H2O2 的目的____________.
(3) Ⅱ中加 Cu2(OH)2CO3 的目的是_________,其优点是___________.
(4) Ⅲ加热煮沸时发生的化学反应的离子方程式为 _____________.
(5) V 中加 H2SO4 调节 pH=1 是为了____________,某工程师认为上述流程中所加的 A 物质并不理想,需作改进,其理由是_________,若你是工程师,将对所加的 A 物质作何改进?请提出建议_________.