题目内容
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱.根据要求完成下列各小题.
(1)实验装置:
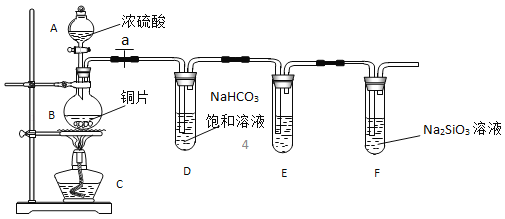
填写所示仪器名称B:______
(2)实验步骤:
连接仪器、_______、加药品后,打开a、然后滴入浓硫酸,加热.
(3)问题探究:(已知酸性强弱:亚硫酸>碳酸)
①铜与浓硫酸反应的化学方程式是____;装置E中酸性KMnO4溶液的作用是________ ;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是__________;
③依据试管D中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性_____(填“能”或“否”),试管D中发生反应的离子方程式是_______
【答案】圆底烧瓶 检查装置的气密性 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 除去SO2气体 E中溶液颜色变浅,F试管中出现白色沉淀 否 SO2+2HCO3-=SO32-+H2O+2CO2
CuSO4+SO2↑+2H2O 除去SO2气体 E中溶液颜色变浅,F试管中出现白色沉淀 否 SO2+2HCO3-=SO32-+H2O+2CO2
【解析】
探究碳、硅元素的非金属性的相对强弱,可以利用其最高价氧化物对应水化物的酸性强弱来判断,根据强酸制弱酸的原理,向硅酸钠中通入二氧化碳气体,硅酸钠溶液变浑浊可以得出,以此分析解答。
(1)该实验装置包括二氧化硫的制备、二氧化碳气体的制备、二氧化硫气体的除去方法以及二氧化碳气体通入硅酸钠中,利用生成的二氧化硫与水反应生成亚硫酸,亚硫酸与碳酸氢钠反应生成二氧化碳,其中B是圆底烧瓶,
故答案为:圆底烧瓶;
(2)实验时,连接好装置后要先检查装置的气密性,再向其中加药品,再进行实验,
故答案为:检查装置的气密性;
(3)①浓硫酸具有强氧化性,在加热的条件下,铜与浓硫酸反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。由于从装置D中出来的气体可能含有SO2,会干扰实验,所以酸性高锰酸钾溶液的作用是除去SO2气体,
CuSO4+SO2↑+2H2O。由于从装置D中出来的气体可能含有SO2,会干扰实验,所以酸性高锰酸钾溶液的作用是除去SO2气体,
故答案为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;除去SO2气体;
CuSO4+SO2↑+2H2O;除去SO2气体;
②根据较强的酸制备较弱的酸可知,盛有Na2SiO3溶液的试管中出现白色沉淀时,且确认没有SO2干扰时,即可以说明碳元素的非金属性比硅元素非金属性强,
故答案为:E中溶液颜色变浅,F试管中出现白色沉淀;
③S元素的最高价氧化物的水化物是硫酸,而与D中碳酸氢钠反应的是亚硫酸,所以不能依据试管D中的实验现象来证明硫元素的非金属性强于碳元素的非金属性。D中发生反应的离子方程式是SO2+2HCO3-=SO32-+H2O+2CO2,
故答案为:否;SO2+2HCO3-=SO32-+H2O+2CO2。

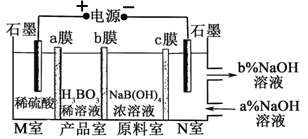
【题目】工业上以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分为:Na2Cr2O7·2H2O),其主要工艺流程如下:
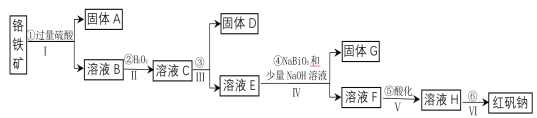
查阅相关资料得知:
i.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下能将Cr3+转化为CrO42-,自身被还原为Bi(OH)3固体。
ii.
物质 | 开始沉淀的pH | 完全沉淀的pH |
Fe(OH)3 | 2.7 | 3.7 |
Al(OH)3 | 3.4 | 4.4 |
Cr(OH)3 | 4.6 | 5.9 |
Fe(OH)2 | 7.5 | 9.7 |
Bi(OH)3 | 0.7 | 4.5 |
回答下列问题:
(1)将铬铁矿矿石粉碎的目的是________________________________________。
(2)操作I、III、IV用到的主要玻璃仪器有玻璃棒和___________(填仪器名称)。
(3)写出④反应的化学方程式_____________________________________________。
(4)⑤中酸化是使CrO42-转化为Cr2O72-![]() 写出该反应的离子方程式______。
写出该反应的离子方程式______。
(5)将溶液H经下列操作:蒸发浓缩,__________,过滤,洗涤,干燥即得红矾钠。
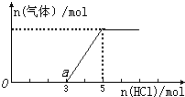
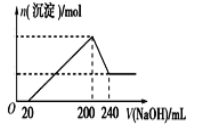
(6)取一定质量的固体D溶解于200 mL的稀硫酸中,向所得溶液中加入5.0 mol/L的NaOH溶液,生成沉淀的物质的量(n)与加入NaOH溶液的体积(V)关系如图所示,则稀硫酸的浓度为_________,固体D中含Fe化合物的物质的量为___________。
【题目】化学变化中伴随着能量的转化,在理论研究和生产生活中有很重要的作用。
Ⅰ.催化剂是化工技术的核心,绝大多数的化工生产均需采用催化工艺。
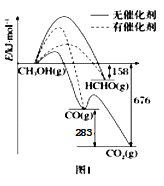
(1)人们常用催化剂来选择反应进行的方向.图1所示为一定条件下1 mol CH3OH 与O2发生反应时.生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去]。在有催化剂作用下,CH3OH与O2反应主要生成________(填“CO”、“CO2”或“HCHO”);2HCHO(g)+O2(g)=2CO(g)+2H2O(g) △H=________。
Ⅱ.第三代混合动力车,可以用电动机,内燃机或二者结合推动车辆。汽车上坡或加速时,电动机提供推动力,降低汽油的消耗;在刹车或下坡时,电池处于充电状态。
(2)混合动力车的内燃机以汽油为燃料,汽油(以辛烷C8H18计)和氧气充分反应,生成1 mol 水蒸气放热550kJ;若1 g水蒸气转化为液态水放热2.5kJ,则辛烷燃烧热的热化学方程式为_____________。

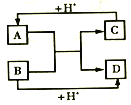
(3)混合动力车目前一般使用镍氢电池,该电池中镍的化合物为正极,储氢金属(以M表示)为负极,碱液(主要为KOH)为电解质溶液。镍氢电池充放电原理示意如图,其总反应式为: H2+2NiOOH![]() 2Ni(OH)2。
2Ni(OH)2。
根据所给信息判断,混合动力车上坡或加速时.乙电极周围溶液的pH______(填“增大”,“减小”或“不变”),该电极的电极反应式为_______________。
(4)远洋轮船的钢铁船体在海水中易发生电化学有腐蚀中的______腐蚀。为防止这种腐蚀,通常把船体与浸在海水里的Zn块相连,或与像铅酸蓄电池这样的直流电源的______(填“正”或“负”)极相连。
Ⅲ.A、B、C三种强电解质,它们在水中电离出的离子如表所示:
阳离子 | Ag+ Na+ |
阴离子 | NO3- SO42 - Cl- |
如图1所示的装置中,甲、乙、丙三个烧杯依次分别盛放足量的A、B、C三种溶液。电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加了27克。常温下各烧杯中溶液的pH与电解时间t的关系图如图2所示。据此回答下列问题:
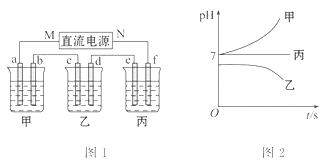
(5)M为电源的______极(填写“正”或“负”),甲为__________(填写化学式)。
(6)计算电极f上生成的气体在标准状况下的体积_________。
(7)写出乙烧杯中的电解池反应______________________。
(8)若电解后甲溶液的体积为25 L,则该溶液的pH为_______。
(9)要使丙恢复到原来的状态,应加入_______g______。(填写化学式)