题目内容
设阿伏加德罗常数值为NA,则下列说法正确的是
A. 1.8g的NH4+离子中含有的电子数为NA
B. 含1molFeCl3的饱和溶液滴入沸水中制得的Fe(OH)3胶体,此胶体中含有Fe(OH)3胶粒数为NA
C. 7.8g Na2O2与CO2完全反应转移电子数为0.2NA
D. 4.6g Na投入100mL 1mol/L盐酸中产生氢气分子数为0.05NA
练习册系列答案
相关题目
我国从国外进口某原料经测定主要含有A、B、C、D、E五种前四周期元素,且原子序数依次增大。元素A、B、C、D、E的原子结构等信息如下:
元素 | 元素性质或原子结构 |
A | 周期表中原子半径最小的元素 |
B | 原子核外有三种不同的能级且各个能级所填充的电子数相同 |
C | 最外层p轨道半充满 |
D | 位于短周期,其原子的核外成对电子数是未成对电子数的3倍 |
E | 位于第四周期,内层电子全充满,且原子的最外层电子数与A的相同 |
请回答下列问题(用A、B、C、D、E所对应的元素符号作答):
(1)B、C、D第一电离能由小到大为_________________。
(2)E的基态原子的核外电子排布式为____________。
(3)A2B2D4常用作除锈剂,该分子中B的杂化方式为______________;1 mol A2B2D4分子中含有σ键数目为_____________。
(4)与化合物BD互为等电子体的阴离子化学式为_____________(任写一种)。
(5)B2A6、C2A4分子中均含有18个电子,它们的沸点相差较大,主要原因是____________。
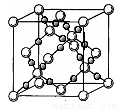
(6)BD2在高温高压下所形成晶体的晶胞如图所示。一个该晶胞中含___________个D原子。


 C. CO
C. CO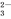 D.OH-
D.OH-
 +2OH-= CaCO3↓+CO
+2OH-= CaCO3↓+CO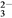 +2H2O
+2H2O
