题目内容
【题目】某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得: 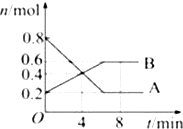
(1)该反应的化学方程式为 .
(2)反应开始至4min时,B的平均反应速率为 .
(3)第4min时,正、逆反应速率的大小关系为:v(正)v(逆)(填“>”、“<”或“=”,下同).
(4)第8min时,v(正)v(逆).
【答案】
(1)2A ![]() B
B
(2)0.lmol/(L?min)
(3)>
(4)=
【解析】解:(1.)由图可知,从反应开始,A的物质的量减少,B的物质的量增加,则A为反应物、B为生成物,开始至4min时,A减少0.8mol﹣0.4mol=0.4mol,B增加0.4mol﹣0.2mol=0.2mol,由反应速率之比等于化学计量数之比可知,A、B的化学计量数比为2:1,且后来达到平衡状态,则反应为2A ![]() B,所以答案是:2A
B,所以答案是:2A ![]() B;
B;
(2.)反应开始至4min时,B的平均反应速率为 ![]() =0.lmol/(Lmin),所以答案是:0.lmol/(Lmin);
=0.lmol/(Lmin),所以答案是:0.lmol/(Lmin);
(3.)第4min时,A的物质的量仍在减少,为正反应阶段,正、逆反应速率的大小关系为:v(正)>v(逆),所以答案是:>;
(4.)第8min时,A、B的物质的量不再变化,达到平衡状态,则v(正)=v(逆),所以答案是:=.
【考点精析】本题主要考查了化学平衡的计算的相关知识点,需要掌握反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%才能正确解答此题.

【题目】对下列实验现象的解释不正确的是
选项 | 实验现象 | 解释 |
A | C12使鲜艳的红色花瓣褪色 | Cl2具有强还原性 |
B | NH3与HCl气体接触时有白烟产生 | NH3与HCl反应生成固体小颗粒 |
C | 新切开的Na表面在空气中很快变暗 | Na容易与空气中的氧气等反应 |
D | 氯化铝溶液中滴入过量的氢氧化钠溶液,白色沉淀溶解 | 氢氧化铝具有两性 |
A. A B. B C. C D. D