题目内容
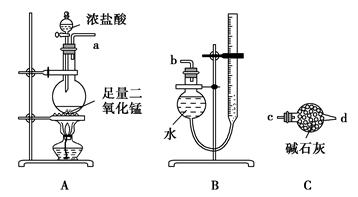
下列药品和装置合理且能完成相应实验的是
| A.喷泉实验 | B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 | D.验证苯中是否有碳碳双键 |
D
解析试题分析:一氧化氮不溶于水,不能产生很大的压强差,烧杯中的水不能倒吸入圆底烧瓶,故A错误;氯化铵和消石灰固体混和加热时能反应,生成氯化钙、氨气和水蒸气,氨气可用向下排气法收集,但是逸出的水蒸气遇冷变成液态水,所以试管底低于试管口时会造成安全事故,造成试管炸裂,试管底必须略高于试管口,故B错误;氯化亚铁与氢氧化钠溶液反应,生成氢氧化亚铁沉淀和氯化钠,但是氢氧化亚铁易被空气中的氧气氧化为氢氧化铁沉淀,故C错误;碳碳双键与Br2能发生加成反应,能被酸性高锰酸钾溶液氧化,若苯能使溴水褪色,能使酸性高锰酸钾溶液褪色,说明苯分子中含有碳碳双键,若都不褪色,说明苯分子中不含碳碳双键,故D正确。
考点:考查化学实验方案的设计与评价,涉及NO的溶解性、氨气的制备、氢氧化亚铁沉淀的制备、碳碳双键的检验等。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
如下实验操作正确且能达到实验目的的是
| A.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集 |
| B.在蒸发皿中给十水碳酸钠加热脱水 |
| C.用酸式滴定管量取6.55mL的KMnO4溶液 |
| D.用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物 |
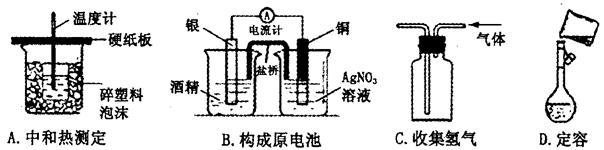
下述实验能达到预期目的的是
| A.甲图:验证铜与稀硝酸反应的气体产物只有NO |
| B.乙图:实验室制取乙酸乙酯 |
| C.丙图:验证钢铁片发生吸氧腐蚀 |
| D.丁图:证明在相同温度下Mg(OH)2的溶解度大于Fe(OH)3 |
从下列实验事实中得到的结论,正确的是
| | 实验事实 | 结论 |
| A | 将纯铜片和另一种金属M用导线连接,同时插入稀硫酸中,铜片表面有气泡冒出 | 金属活动性:M > Cu |
| B | 将SO2通入酸性KMnO4溶液中,红色褪去 | SO2有漂白性 |
| C | CO2通入苯酚钠溶液中,出现浑浊 | 酸性:苯酚 < 碳酸 |
| D | Cl2的水溶液可以导电 | Cl2是电解质 |
下列实验方案不能达到实验目的的是
| | 实验目的 | 实验方案 |
| A | 研究催化剂对过氧化氢分解速率的影响 | 分别向两支试管中加入等体积、等浓度的过氧化氢溶液,再在其中一只试管中加入少量MnO2 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2mol/LNaOH溶液中先加入3滴1mol/L MgCl2溶液,再加入3滴1mol/L FeCl3溶液 |
| C | 可以鉴别这两种溶液 | 将Na2CO3溶液与HCl溶液相互滴加 |
| D | 测定铝箔中氧化铝的含量 | 取a g铝箔与足量稀盐酸充分反应,将逸出的气体通过碱石灰后,测其体积为bL(标准状况下) |
某同学想利用实验证明高锰酸钾溶液的紫色是MnO4-的颜色,而不是K+的颜色,他设计的下列实验步骤中没有意义的是( )
| A.将高锰酸钾晶体加热分解,所得固体质量减小 |
| B.观察氯化钾溶液没有颜色,表明溶液中的K+无色 |
| C.在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+不反应 |
| D.在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫色褪去,表明MnO4-为紫色 |

 所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。
所示简易装置进行实验。实验操作如下:按图安装好仪器,在广口瓶中盛放足量的H2O2水溶液,用规格为20mL的针筒抽气100次,使空气中的SO2被H2O2水溶液充分吸收(SO2+H2O2=H2SO4)。在吸收后的水溶液中加入足量的BaCl2溶液,生成白色沉淀,经过滤、洗涤、干燥等步骤后进行称量,得白色固体0.182mg。 2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。
2CuCl2+O2测定铜的近似相对原子质量,可供选择的装置如图所示。