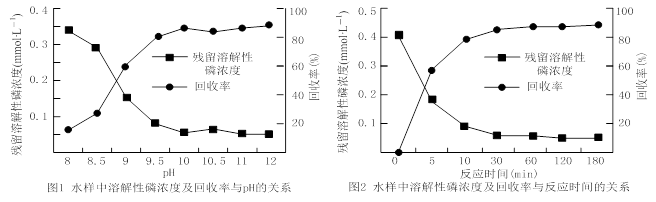
题目内容
如下实验操作正确且能达到实验目的的是
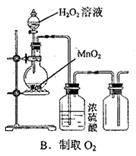
| A.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集 |
| B.在蒸发皿中给十水碳酸钠加热脱水 |
| C.用酸式滴定管量取6.55mL的KMnO4溶液 |
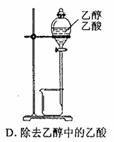
| D.用分液漏斗分离溴乙烷与氢氧化钠溶液发生反应后的生成物 |
C
解析试题分析:稀硝酸是氧化性酸,硝酸根离子的氧化性远大于氢离子,因此与氢前金属反应时不能产生氢气,只能产生一氧化氮,NO可用排水法收集,故A选项错误;十水碳酸钠是固体,加热固体物质不能在表面皿中进行,应该在坩埚或试管中进行,故B选项错误;高锰酸钾具有强氧化性,能腐蚀橡胶,因此只能用酸式滴定管量取,酸式滴定管直径较小,能精确到0.01mL,故C选项正确;溴乙烷与氢氧化钠水溶液混合加热得到乙醇、溴化钠,乙醇、溴化钠都易溶于水,不会分层,因此不能用分液漏斗分离,故D选项错误。
考点:考查考生对常见单质及化合物的性质的掌握程度;考查考生对物质的加热、量取、分离、提纯等基本实验操作知识和技能的掌握程度。

练习册系列答案
 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
下列实验操作正确且能达到预期目的的是
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 证明CH2=CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液 |
| C | 比较盐酸与醋酸的酸性强弱 | 分别测定同温同浓度NaCl与CH3COONa溶液的pH |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
下列装置能达到实验目的是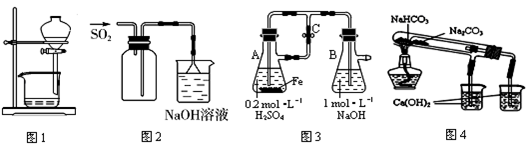
| A.图1用于放出碘的四氯化碳溶液 |
| B.图2用于实验室收集SO2 |
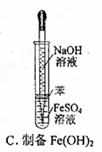
| C.图3用于实验室制备Fe(OH)2 |
| D.图4用于比较NaHCO3和Na2CO3热稳定性 |
下列各图所示实验设计能达到相应实验目的的是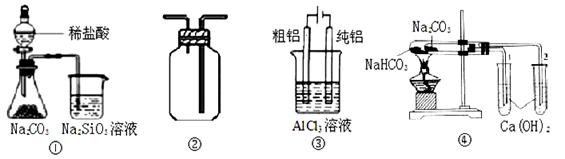
| A.用图①装置验证氯、碳、硅元素非金属性 |
| B.用图②装置能收集O2、CO2和H2 |
| C.用图③装置电解精炼铝 |
| D.用图④装置验证NaHCO3和Na2CO3的热稳定性 |
测定Cu(NO3)2?nH2O的结晶水含量,下列方案中不可行的是( )
| A.称量样品→加热→冷却→称量CuO |
| B.称量样品→加热→冷却→称量Cu(NO3)2 |
| C.称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
| D.称量样品→加NaOH→过滤→加热→冷却→称量CuO |
下列实验不能达到目的的是
| 选项 | 实验操作 | 实验目的 |
| A | 向5 mL 0.1 mol/L AgNO3溶液中滴加3滴0.1 mol/L NaCl溶液,产生白色沉淀;再向其中滴加3滴0.1 mol/L的KI溶液,有黄色沉淀产生 | 验证Ksp(AgCl)> Ksp(AgI) |
| B | 向适量样品溶液中滴加KSCN溶液 | 检验FeSO4溶液是否被氧化 |
| C | 向适量样品溶液中滴加盐酸酸化,再滴加BaCl2溶液 | 检验Na2SO3溶液是否被氧化 |
| D | 向Na2SiO3溶液中通入CO2 | 验证非金属性:碳>硅 |
下列药品和装置合理且能完成相应实验的是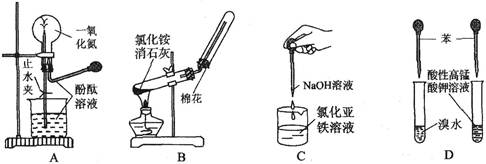
| A.喷泉实验 | B.实验室制取并收集氨气 |
| C.制备氢氧化亚铁 | D.验证苯中是否有碳碳双键 |