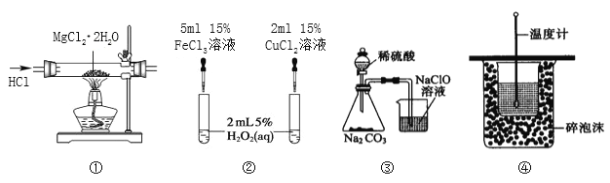
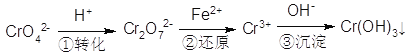题目内容
【题目】25 ℃时,浓度均为0.1mol/L的下列五种钠盐溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
回答下列问题:
(1)下列反应不能发生的是: ;
a.CO32-+CH3COOH=CH3COO-+CO2↑+H2O
b.ClO-+CH3COOH=CH3COO-+HClO
c.CO32-+HClO=CO2↑+H2O+ClO-
d.2ClO-+CO2+H2O=CO32-+2HClO
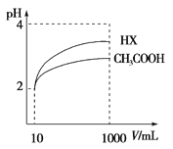
(2)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程pH变化如右上图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,写出HX的电离方程式 。
(3)某温度下,纯水中c (H+)=2.0×10-7 mol·L1, 0.9mol·L-1NaOH溶液与0.1mol·L-1HCl溶液等体积混合后(不考虑溶液体积变化),溶液的pH= 。
(4)等浓度等体积的CH3COONa和NaCN混合后,所得混合溶液中各离子浓度的大小关系是: 。
(5)某二元酸H2B在水中的电离方程式为H2B = H+ + HB— ;HB—![]() H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
H++ B2—,则NaHB溶液显 (填“酸性”、“中性”或“碱性”)。
【答案】(1)c、d (2)大于 HX![]() H++X— (3)13
H++X— (3)13
(4)C(Na+)> C(CH3COO-)> C(CN-)> C(OH-)> C(H+) (5)酸性
【解析】
试题分析:(1)相同温度、相同浓度时,酸越弱,水解程度越大,强碱盐溶液的pH越大,可知酸性CH3COOH>H2CO3>HClO>HCN>HCO3-,根据强酸制弱酸的原则,下列反应中HClO不能制碳酸、而HClO可与CO32-反应生成HCO3-,故c、d不能发生;
(2)根据图象分析知道,起始是两种溶液中c(H+)相同,c(较弱酸)>c(较强酸),稀释过程中较弱酸的电离程度增大,故在整个稀释过程中较弱酸的c(H+)一直大于较强酸的c(H+),稀释相同倍数,HX的pH变化比CH3COOH的大,故HX酸性强,电离平衡常数大,HX的电离方程式为HX![]() H++X— ;
H++X— ;
(3)纯水电离生成的c(H+)=c(OH-),Kw=c(H+)×c(OH-),过量的c(OH-)=![]() =0.4mol/L,由该温度下的Kw可知,c(H+)=
=0.4mol/L,由该温度下的Kw可知,c(H+)=![]() =10-13molL-1,所以pH=13;
=10-13molL-1,所以pH=13;
(4)等浓度等体积的CH3COONa和NaCN混合后,CN-离子水解程度大于CH3COO-,混合溶液显碱性,
混合溶液中各离子浓度的大小关系是:C(Na+)> C(CH3COO-)> C(CN-)> C(OH-)> C(H+);
(5)某二元酸H2B在水中的电离方程式为H2B =H+ + HB— ;HB—![]() H++ B2-,则NaHB溶液中HB-只电离不水解,溶液一定显酸性。
H++ B2-,则NaHB溶液中HB-只电离不水解,溶液一定显酸性。

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案