题目内容
7.在下列各说法中,正确的是( )| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
分析 A、放热反应的焓变小于0,吸热反应的焓变大于0;
B、热化学方程式中的化学计量数只表示物质的量,不表示分子数;
C、中和热是指稀的强酸和强碱当生成1mol水时所放出的热量;
D、燃烧热是指在101K时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态.
解答 解:A、放热反应的焓变小于0,吸热反应的焓变大于0,故△H>0表示吸热反应,△H<0表示放热反应,故A错误;
B、热化学方程式中的化学计量数只表示物质的量,不表示分子数,所以可用分数或小数表示,故B正确;
C、中和热是指稀的强酸和强碱当生成1mol水时所放出的热量,而1mol硫酸和1mol氢氧化钡反应时生成了2mol水,故此时放出的热量不是中和热,故C错误;
D、燃烧热是指在101K时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,此时生成的水必须为液态,而1mol氢气和0.5mol氧气反应生成的水的状态未知,故此时放出的热量不一定是燃烧热,故D错误.
故选B.
点评 本题考查了中和热、燃烧热的概念以及热化学方程式中计量数的含义,难度不大.

练习册系列答案
相关题目
15.在体积为1L的两个恒容密闭容器中,分别充入1molCO和1molH2O(g)的混合气体,进行如下化学反应:CO(g)+H2O(g)?CO2(g)+H2(g),反应物CO的物质的量在不同温度时物质的量随时间的变化如下表所示,回答下列问题:
(1)1100℃时,前10min该反应的化学反应速率v(CO2)=0.025mol/(L.min).
(2)计算1100℃时该反应的化学平衡常数K=$\frac{4}{9}$.
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变
(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)
(d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向右移动(选填“向右”或“向左”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
| 0min | 10min | 20min | 30min | 40min | 50min | |
| 830℃ | 1mol | 0.8mol | 0.65mol | 0.55mol | 0.5mol | 0.5mol |
| 1100℃ | 1mol | 0.75mol | 0.6mol | 0.6mol | 0.6mol | 0.6mol |
(2)计算1100℃时该反应的化学平衡常数K=$\frac{4}{9}$.
(3)能判断该反应是否达到化学平衡状态的依据是bc.
(a)容器中压强不变
(b)混合气体中c(CO)不变
(c)v逆(H2)=v正(H2O)
(d)c(CO2)=c(CO)
(4)1100℃时达到平衡后,若向容器中再充入2molCO和2molH2O(g),平衡向右移动(选填“向右”或“向左”或“不”),再达到平衡时,H2百分含量不变(选填“增大”或“减小”或“不变”).
12.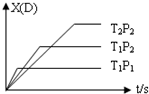 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )| A. | 正反应为放热反应 | B. | m+n>p+q | ||
| C. | T1<T2 | D. | P1<P2 |
16.根据陈述的知识,类推得出的结论正确的是( )
| A. | 镁条在空气中燃烧生成的氧化物是MgO,则钠在空气中燃烧生成的氧化物是Na2O | |
| B. | 乙烯(CH2=CH2)可使酸性高锰酸钾溶液褪色,则丙烯(CH3-CH=CH2)也可以使其褪色 | |
| C. | CO2和SiO2化学式相似,则CO2与SiO2的物理性质也相似 | |
| D. | 金刚石的硬度大,则C60的硬度也大 |
17.已知有四种有机物A、B、C、D,其分子式均为C3H6O2,分子结构中均有甲基把它们分别进行实验并记录现象如下:
则A、B的结构简式为:ACH3CH2COOH;BCH3CHOHCHO;C、D的名称:C甲酸乙酯;D乙酸甲酯.
| 有机物 | 氢氧化钠 | 银氨溶液 | 新制氢氧化铜 | 金属钠 |
| A | 发生中和反应 | 不反应 | 溶解 | 放出氢气 |
| B | 不反应 | 发生银镜反应 | 生成红色沉淀 | 放出氢气 |
| C | 发生水解反应 | 发生银镜反应 | 生成红色沉淀 | 不反应 |
| D | 发生水解反应 | 不反应 | 不反应 | 不反应 |
 用化学方程式表示在一定条件下下列物质间的转化关系.指出哪些是氧化还原反应,哪些是非氧化还原反应.对于氧化还原反应,指出氧化剂和还原剂.
用化学方程式表示在一定条件下下列物质间的转化关系.指出哪些是氧化还原反应,哪些是非氧化还原反应.对于氧化还原反应,指出氧化剂和还原剂. 与
与
 与
与
 与
与
 与
与