题目内容
8.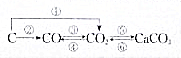 用化学方程式表示在一定条件下下列物质间的转化关系.指出哪些是氧化还原反应,哪些是非氧化还原反应.对于氧化还原反应,指出氧化剂和还原剂.
用化学方程式表示在一定条件下下列物质间的转化关系.指出哪些是氧化还原反应,哪些是非氧化还原反应.对于氧化还原反应,指出氧化剂和还原剂.
分析 在反应前后有元素的化合价变化的化学反应属于氧化还原反应;氧化还原反应中,氧化剂得电子被还原,所含元素化合价降低,还原剂失电子被氧化,所含元素化合价升高,结合各反应方程式解答.
解答 解:①碳和大量氧气反应生成二氧化碳:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,属于氧化还原反应,氧元素从0→-2,氧气为氧化剂,碳元素从0→+4,碳为还原剂,
②碳和少量氧气反应生成一氧化碳:2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,属于氧化还原反应,氧元素从0→-2,氧气为氧化剂,碳元素从0→+2,碳为还原剂,
③一氧化碳和氧气反应生成二氧化碳:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,属于氧化还原反应,氧元素从0→-2,氧气为氧化剂,碳元素从+2→+4,一氧化碳为还原剂,
④二氧化碳和碳反应生成一氧化碳:CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,属于氧化还原反应,碳元素从+4→+2,二氧化碳为氧化剂,碳单质碳元素从0→+2,碳为还原剂,
⑤氢氧化钙和二氧化碳反应生成碳酸钙和水,反应的化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O,为复分解反应,不属于氧化还原反应,
⑥碳酸钙高温分解:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,无化合价变化,不属于氧化还原反应,
答:C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2,属于氧化还原反应,氧气为氧化剂,碳为还原剂;2C+O2$\frac{\underline{\;点燃\;}}{\;}$2CO,属于氧化还原反应,氧气为氧化剂,碳为还原剂,2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,属于氧化还原反应,氧气为氧化剂,一氧化碳为还原剂,CO2+C$\frac{\underline{\;高温\;}}{\;}$2CO,属于氧化还原反应,二氧化碳为氧化剂,碳为还原剂,CO2+Ca(OH)2═CaCO3↓+H2O、CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,属于非氧化还原反应.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重基本概念的考查,题目难度不大.

| A. | 6.02×1023倍 | B. | 6.02倍 | C. | 98倍 | D. | 3.01×1023倍 |
| A. | 同系物之间互为同分异构体 | |
| B. | 甲基与氢氧根离子能直接结合生成有机物甲醇 | |
| C. | 同系物之前各元素的质量分数一定相同 | |
| D. | 含不同碳原子数的烷烃一定是互为同系物的关系 |
| A. | NH3+HCl═NH4Cl | B. | 4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O | ||
| C. | 3CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu+N2+3H2O | D. | 8NH3+3Cl2═6NH4Cl+N2 |
 由软锰矿制备高锰酸钾的主要反应如下:
由软锰矿制备高锰酸钾的主要反应如下:熔融氧化3MnO2+KClO3+6KOH$\stackrel{高温}{→}$3K2MnO4+KCl+3H2O
加酸歧化3K2MnO4+2CO2→2KMnO4+MnO2↓+2K2CO3
已知相关物质的溶解度(20℃)
| 物质 | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
| 溶解度g/100g | 111 | 33.7 | 11.1 | 6.34 |
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和cd.(填序号)
a.表面皿 b.蒸发皿 c.铁坩埚 d.泥三角
(2)加酸时不宜用硫酸的原因是生成K2SO4溶解度小,会降低产品的纯度;不宜用盐酸的原因是盐酸具有还原性,会被氧化,降低产品的量.
(3)采用电解法也可实现K2MnO4的转化,2K2MnO4+2H2O$\stackrel{通电}{→}$2KMnO4+2KOH+H2↑.与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,原子利用率高.
(4)草酸钠滴定法测定高锰酸钾的质量分数步骤如下:
(已知 涉及到的反应:Na2C2O4+H2SO4→H2C2O4(草酸)+Na2SO45H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O Na2C2O4的式量:134、KMnO4的式量:158)
Ⅰ称取0.80g 的高锰酸钾产品,配成50mL溶液.
Ⅱ称取0.2014gNa2C2O4,置于锥形瓶中,加入蒸馏水使其溶解,再加入少量硫酸酸化.
Ⅲ将瓶中溶液加热到75~80℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点.消耗高锰酸钾溶液8.48mL,则样品中高锰酸钾的质量分数为0.700(保留3位小数).达到滴定终点的标志是无色变为紫色且半分钟不褪色.
(5)加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度偏高.(填“偏高”、“偏低”或“无影响”)
(6)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,其原因可能为Mn2+可能是该反应的催化剂,随着Mn2+的产生,反应速率大大加快.
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 热化学方程式中的化学计量数只表示物质的量,可以是分数 | |
| C. | 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 | |
| D. | 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热 |
| A. | Na+ K+ HCO3- Cl- | B. | NH4+ Mg2+ SO32- Cl- | ||
| C. | K+ Na+ SO42- Cl- | D. | K+ Cu2+ CO32- NO3- |
 实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空:
实验室制取少量溴乙烷的装置如图所示.根据题意完成下列填空: