题目内容
【题目】工业上利用合成气(CO、CO2和H2)来生产甲醇,有关反应的化学方程式及其在不同温度下的化学平衡常数如下表所示。
化学反应 | 平衡 常数 | 温度/℃ | ||
500 | 700 | 800 | ||
①2H2(g)+CO(g)CH3OH(g)△H1 | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g)H2O(g)+CO(g)△H2 | K2 | 1.0 | 1.70 | 2.52 |
③3H2(g)+CO2(g)CH3OH(g)+H2O(g)△H3 | K3 | |||
(1)若合成气为H2和CO2,发生反应III。
①由H2(g)和CO2(g)合成CH3OH(g)的△H3=___________。(用△H1、△H2表示)
②下列措施能使反应III的平衡体系中n(CH3OH)/n(H2)增大的是___________(填字母代号)
A.将水蒸气从体系中分离出去 B.恒压时充入氦气
C.升高温度 D.恒容时再充入一定量CO2
③500℃测得反应Ⅲ在10分钟时,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分別为2mol·L-1、1.0 mol·L-1、0.6 mol·L-1、0.6 mol·L-1,则此时v(正)___________V(逆)(填“>”“=”或“<”)。从开始到该时刻,用H2表示反应的平均速率为v(H2)=___________。
(2)用合成气H2、CO和CO2生产甲醇。当n(H2)/n(CO+CO2)=a时,体系中CO平衡转化率[α(CO)]与温度和压强关系的一些散点如图所示。520K压强为P时,α(CO)处于C点,

①若保持温度不变,增大压强,则可能是图中的___________点(填字母,下同)。
②若保持压强不变,升高温度,则可能是图中的___________点。
(3)利用甲醇燃料电池进行电解的装置如图1,其中A、B、D均为石墨电极,C为铜电极。工作一段时间后断开K,此时AB两极上生成等物质的量的气体。
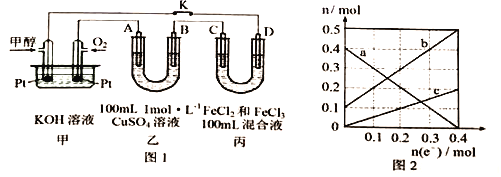
①乙中B电极为___________(填“阴极”或“阳极”),该电极上生成的气体在标准状况下的体积为___________;
②丙装置溶液中金属阳离子的物质的量(n)与转移电子的物质的量[n(e-)]变化关系如图2,则图中c线表示的是___________(填离子符号)的变化。
【答案】H1+H2 A D > 0.18 mol·L1·min1 D I 阴极 2. 24 L Cu2+
【解析】
(1)①根据盖斯定律分析解答;
②根据盖斯定律反应①+反应②得到反应③,可得500°C时,平衡常数K3=K1K2=2.5×1.0=2.5,700°C时平衡常数K3=K1K2=0.34×1.7=0.578,温度升高平衡常数减小,说明反应为放热反应,结合化学平衡的影响因素分析判断;
③根据Qc与K的关系分析判断v正、v逆的大小;先计算用H2O表示反应的平均速率,再根据速率之比等于化学反应速率之比计算用H2表示反应的平均速率;
(2)首先根据温度对K的影响分析判断反应①②③的热效应,再根据改变的条件对反应①②③的影响分析判断;
(3)①在燃料电池中通入燃料的为负极,通入氧气的为正极,结合原电池和电解池的工作原理分析解答;乙电解池中阴极上铜离子得电子生成铜,电极反应为:Cu2++2e-=Cu,工作一段时间后,断开K,此时A,B两极上产生的气体体积相同说明铜离子全部放电后溶液中氢离子放电生成氢气,电极反应为,2H++2e-=H2↑,根据得失电子守恒结合电极反应式分析解答;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,据此判断。
(1)①反应①2H2(g)+CO(g)CH3OH(g)△H1,反应②H2(g)+CO2(g)H2O(g)+CO(g)△H2,根据盖斯定律,将反应①+反应②得:反应③3H2(g)+CO2(g)CH3OH(g)+H2O(g)△H3=H1+H2,故答案为:H1+H2;
②结合反应①+②得到反应③,可得500°C时,平衡常数K3=K1K2=2.5×1.0=2.5,700°C时平衡常数K3=K1K2=0.34×1.7=0.578,温度升高平衡常数减小,说明反应为放热反应,3H2(g)+CO2(g)CH3OH(g)+H2O(g)△H3<0。A.将H2O(g)从体系中分离出去,平衡正向移动,![]() 比值增大,故A正确;B.恒压时充入He(g),使体系压强增大,分压不变,平衡不移动,
比值增大,故A正确;B.恒压时充入He(g),使体系压强增大,分压不变,平衡不移动,![]() 比值不变,故B错误;C.反应为放热反应,升高温度平衡逆向移动,
比值不变,故B错误;C.反应为放热反应,升高温度平衡逆向移动,![]() 比值减小,故C错误;D.恒容时再充入一定量CO2,平衡正向移动,
比值减小,故C错误;D.恒容时再充入一定量CO2,平衡正向移动,![]() 比值增大,故D正确;故答案为:AD;
比值增大,故D正确;故答案为:AD;
③平衡常数是利用生成物平衡浓度幂次方乘积除以反应物平衡浓度幂次方乘积,结合反应①+②得到反应③,可得平衡常数K3=K1K2=2.5×1.0=2.5,500℃时,测得反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度分别为2mol·L-1、1.0 mol·L-1、0.6 mol·L-1、0.6 mol·L-1,Qc=![]() =0.045<K=2.5,则此时v正>v逆;从开始到该时刻,用H2O表示反应的平均速率为v(H2O)=
=0.045<K=2.5,则此时v正>v逆;从开始到该时刻,用H2O表示反应的平均速率为v(H2O)=![]() = 0.06mol·L1·min1,用H2表示反应的平均速率为v(H2)= 3v(H2O)=3×0.06mol·L1·min1= 0.18 mol·L1·min1,故答案为:>;0.18 mol·L1·min1;
= 0.06mol·L1·min1,用H2表示反应的平均速率为v(H2)= 3v(H2O)=3×0.06mol·L1·min1= 0.18 mol·L1·min1,故答案为:>;0.18 mol·L1·min1;
(2)①上述反应②反应前后物质的量不变,①③反应后物质的量减少,则保持温度不变,增大压强,反应①③平衡正向移动,导致②的平衡也正向移动,CO平衡转化率[α(CO)]增大,可能变成图中的D点,故答案为:D;
②反应①的K随温度升高而减小,说明升高温度,平衡逆向移动;反应②的K随温度升高而增大,说明升高温度,平衡正向移动;保持压强不变,升高温度,反应①平衡逆向移动,反应②平衡正向移动,导致CO平衡转化率[α(CO)]减小,可能变成图中的I点,故答案为:I;
(3)①在燃料电池中通入燃料的为负极,通入氧气的为正极,则B电极为电解池的阴极,铜离子得电子生成铜,电极反应为:Cu2++2e-=Cu,工作一段时间后,断开K,此时A,B两极上产生的气体体积相同说明铜离子全部放电后溶液中氢离子放电生成氢气,电极反应为,2H++2e-=H2↑,设生成气体物质的量为X,溶液中铜离子物质的量为0.1mol,电极反应为:
Cu2+ + 2e- = Cu,
0.1mol 0.2mol
2H+ + 2e- = H2↑,
2x x
A电极为阳极,溶液中的氢氧根离子失电子生成氧气,电极反应为:
4OH--4e-=2H2O+O2↑,
4xx
根据得失电子守恒,0.2+2x=4x,解得x=0.1mol,乙中A极析出的氧气或B极析出的氢气物质的量为0.1mol,在标准状况下的体积为2.24L,故答案为:阴极;2.24L;
②根据转移电子的物质的量和金属阳离子的物质的量的变化,可知,铜离子从无增多,铁离子物质的量减小,亚铁离子增加,a为Fe3+,b为Fe2+,c为Cu2+,故答案为:Cu2+。

 名校课堂系列答案
名校课堂系列答案