题目内容
常温下,0.1 mol·L-1氨水溶液中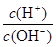 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是
c(NH4+ )>c(NH3·H2O)>c(Cl—)>c(OH-)>c(H+ )
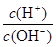 =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是| A.该溶液中氢离子的浓度:c(H+ ) = 1×10-9 mol·L-1 |
| B.0.1 mol·L-1 氨水溶液与0.1 mol·L-1 HCl溶液等体积混合后所得溶液中: c(NH4+ ) + c(H+ ) = c(Cl- ) + c(OH-) |
| C.0.1 mol·L-1 的氨水溶液与0.05 mol·L-1 H2SO4溶液等体积混合后所得溶液中: c(NH4+ ) + c(NH3) + c(NH3·H2O) = 2c(SO42—) |
| D.浓度均为0.1mol·L-1 的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则 |
AD
试题分析:常温下,0.1 mol·L-1氨水溶液中
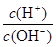 =1×10-8,则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-11mol/L,所以溶液的pH=3,A错误。B中符合电荷守恒,正确;C中恰好反应生成生成硫酸铵,C正确,符合物料守恒;D中溶液呈碱性,说明氨水的电离程度大于氯化铵水解程度,因此D不正确,应该是c(NH4+ )>c(Cl—) >c(NH3·H2O)>c(OH-)>c(H+ ),答案选AD。
=1×10-8,则根据水的离子积常数可知,溶液中氢离子的浓度是1×10-11mol/L,所以溶液的pH=3,A错误。B中符合电荷守恒,正确;C中恰好反应生成生成硫酸铵,C正确,符合物料守恒;D中溶液呈碱性,说明氨水的电离程度大于氯化铵水解程度,因此D不正确,应该是c(NH4+ )>c(Cl—) >c(NH3·H2O)>c(OH-)>c(H+ ),答案选AD。点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固与训练,有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是利用好几种守恒关系,即物料守恒、电荷守恒和质子守恒。

练习册系列答案
相关题目
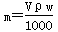
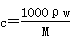
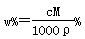
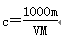
 、Cl-四种离子,且c(NH
、Cl-四种离子,且c(NH 氨水溶液加水稀释,下列说法正确的是
氨水溶液加水稀释,下列说法正确的是 
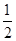 O2(g) = H2O(1)△H= ―285.8kJ/mol
O2(g) = H2O(1)△H= ―285.8kJ/mol =10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )
=10-12,将这两种溶液等体积混合,所得溶液各离子物质的量浓度关系不正确的是( )