题目内容
往20mL硫酸和盐酸的混合溶液中,加入0.05mol/LBa(OH)2溶液时,生成BaSO4的量和溶液的pH变化如右图。试回答:
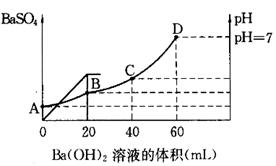
(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。

(1)起始时,混酸中H2SO4的物质的量浓度为
(2)起始时,混酸中盐酸的物质的量浓度为
(3)B点时溶液的pH是 。
(1)0.05mol/L (2)0.2mol/L (3)1
试题分析:(1)根据图像可知,当加入20ml氢氧化钡时,沉淀达到最大值,所以硫酸的物质的量是0.02L×0.05mol/L=0.001mol,则硫酸的浓度是0.001mol÷0.02L=0.05mol/L。
(2)当Ph=7是,酸碱恰好中和,则盐酸的物质的量是2×0.04L×0.05mol/L=0.004mol,则盐酸的浓度是0.004mol÷0.02L=0.2mol/L。
(3)B点相当于是硫酸被中和,则溶液中氢离子的浓度是
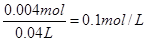 ,所以pH=1。
,所以pH=1。点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固和训练。旨在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是明确图像的变化趋势特点,然后结合题意灵活运用即可。

练习册系列答案
相关题目
 HSO3ˉ+OHˉ,下列说法正确的是
HSO3ˉ+OHˉ,下列说法正确的是 =1×10-8,下列叙述正确的是( )
=1×10-8,下列叙述正确的是( ) =1×10-8,下列叙述错误的是
=1×10-8,下列叙述错误的是