题目内容
一定条件下,在体积为10 L的密闭容器中,1 mol A和1 mol B进行反应:2A(g)+B(g) 2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
2C(g),经60 s达到平衡,生成0.6 mol C。下列说法正确的是
A.以A浓度变化表示的反应速率为0.001 mol·L-1·s-1
B.其他条件不变,将容器体积变为5 L,C的平衡浓度变为原来的2倍
C.其他条件不变,若增大压强,则物质A的转化率减小
D.达到平衡时,C的体积百分含量为0.353
A D
解析试题分析:依据化学平衡三段式列式计算
2A(g)+B(g)═2C(g)
起始量(mol) 1 1 0
变化量(mol)0.6 0.3 0.6
平衡量(mol)0.4 0.7 0.6
A、以A浓度变化表示的反应速率=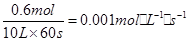 ;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量=
;故A正确;B、其他条件不变,将容器体积变为5L,C的浓度变为原来的2倍,但反应前后气体体积变化,缩小体积压强增大,平衡正向进行,C的平衡浓度变大于原来的2倍,故B错误;C、其他条件不变,若增大压强,平衡正向进行,则物质A的转化率增大,故C错误;D、达到平衡时,C的体积百分含量= 故D正确;故选AD.
故D正确;故选AD.
考点:化学平衡建立

设C+CO2  2CO(正反应为吸热反应),反应速率为υ1;N2+3H2
2CO(正反应为吸热反应),反应速率为υ1;N2+3H2  2NH3(正反应为放热反应),反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
2NH3(正反应为放热反应),反应速率为υ2,对于上述反应,当温度升高时,υ1和υ2的变化情况为
| A.同时增大 | B.同时减小 | C.υ1增大,υ2减小 | D.υ1减小,υ2增大 |
工业上采用乙烯和水蒸气在催化剂(磷酸/硅藻土)表面 合成乙醇,反应原理为:
CH2=CH2(g)+H2O(g)  CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
CH3CH2OH(g),副产物有乙醛、乙醚及乙烯的聚合物等。下图是乙烯的总转化率随温度、压强的变化关系,下列说法正确的是
| A.合成乙醇的反应一定为吸热反应 |
| B.目前工业上釆用250?300℃,主要是在此温度下乙烯的转化率最大 |
| C.目前工业上采用加压条件(7MPa左右),目的是提高乙醇的产率和加快反应速率 |
| D.相同催化剂下,在300℃14.7MPa乙醇产率反而比300℃7MPa低得多,是因为加压平衡向逆反应方向移动 |
下列对于化学反应方向说法正确的是 ( )
| A.反应2A(g)+B(g) =" 3C" (s)+D(g)在一定条件下能自发进行,说明该反应的ΔH>0 |
| B.常温下反应2Na2SO3(s)+O2(g)= 2Na2SO4(s)能自发进行,则ΔH<0 |
C.反应2Mg(s)+CO2(g) C(s)+2MgO(s)能自发进行,则该反应的△H>0 C(s)+2MgO(s)能自发进行,则该反应的△H>0 |
| D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的 △H<0 ,△S>0 |
K、Ki、KW分别表示化学平衡常数、电离常数和水的离子积,下列判断正确的是
| A.在500℃、20MPa、5L的密闭容器中进行合成氨的反应,使用催化剂后K值增大 |
| B.室温下K(HCN)<K(CH3COOH),说明CH3COOH的电离度一定比HCN大 |
| C.25℃时,pH 均为4的盐酸和NH4I(aq)中KW不相等 |
D.2SO2+O2 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 2SO3达平衡后,改变某一条件K值不变,SO2的转化率可能增大、减小或不变 |
下列有关说法正确的是
| A.催化剂通过降低化学反应的焓变加快化学反应速率 |
| B.铅蓄电池充电时,标有“—”的电极应与电源的负极相连 |
| C.温度保持不变,向水中加入钠盐对水的电离一定没有影响 |
| D.向醋酸钠溶液中加水稀释时.溶液中所有离子浓度都减小 |
 zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
zC(g),图I表示200℃时容器中A、B、C物质的量随时间的变化,图Ⅱ表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系。则下列结论正确的是
 pC达到平衡,若:
pC达到平衡,若: 2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )
2C(g) △H<0。2 min后,反应达到平衡,生成C为1.6 mol。则下列分析正确的是 ( )