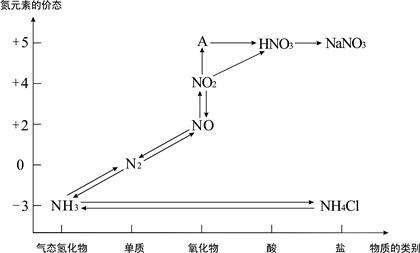
题目内容
氨气是一种重要的工业产品,也是一种重要的化工原料。为研究氨气的制备及性质,某学习小组进行了下面的探究活动:
(1)实验室中往往采用熟石灰与氯化铵制备氨气,写出该反应的化学方程式(注明反应条件)___________________________________________________________。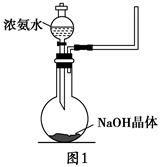
(2)实验室中还可以采用如图1装置(略去了夹持装置)和药品快速制备氨气:
①甲同学不明白该方法中制备氨气的原理,于是学习小组内成员展开了讨论,得出了下面的结论,其中不正确的是________(填字母序号)。
a.氨水中的NH3·H2O分解
b.氨水中存在可逆反应:NH3·H2O NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
NH4++OH-,NaOH晶体使该可逆反应的平衡向左移动
c.反应原理与铵盐、熟石灰制备氨气的反应原理相同
d.NaOH溶于水放出热量,使NH3·H2O分解
②乙同学取质量分数为34%的0.89 g·mL-1的浓氨水10 mL,用过量的NaOH与之混合,然后用500 mL的烧瓶收集氨气。请你计算最多可收集满标准状况下的氨气________个烧瓶。
(3)丙同学进行氨气的喷泉实验探究。
①收集氨气时需要用干燥剂干燥,如图2,装置B中盛装的干燥剂是________。
②该同学利用图3装置,成功地完成了喷泉实验。请你简要地写出该同学操作的正确方法:__________________________________________________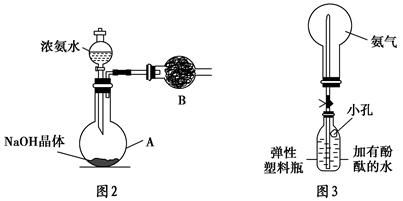
(1)2NH4Cl+Ca(OH)2 2NH3↑+CaCl2+2H2O
2NH3↑+CaCl2+2H2O
(2)①c ②3
(3)①碱石灰 ②用一手指肚堵住塑料瓶上的小孔,然后轻轻挤压塑料瓶,将少量水挤入烧瓶,手指肚离开小孔
解析

 阅读快车系列答案
阅读快车系列答案化学肥料在农业生产中具有重要的作用,关系着农业生产是否丰收。化学肥料在农业生产中的广泛应用,为化学肥料的大规模工业生产提供了舞台。
(1)在合成氨的设备(合成塔)中,设置热交换器的目的是______________。
(2)生产硝酸的过程中常会产生一些氮的氧化物,一般可采用下列两种方法处理。
碱液吸收法:NO+NO2+2NaOH=2NaNO2+H2O
氨还原法:8NH3+6NO2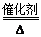 7N2+12H2O(NO也有类似的反应)
7N2+12H2O(NO也有类似的反应)
请从绿色化学的角度分析两种方法的优劣:____________________。
(3)某化肥厂用NH3制备NH4NO3。已知:由NH3制NO的产率是96%,NO制HNO3的产率是92%,则制HNO3所用去的NH3的质量占总耗用NH3质量(不考虑其他损耗)的________%。
(4)硝酸铵是一种常用的氮肥,在贮存和使用该化肥时,把应注意的事项及理由填入下表(填两条应注意的事项及理由即可)。
| | 注意事项 | 理由 |
| ① | ______________ | ____________ |
| ② | ________________ | ____________ |
研究二氧化硫、氮氧化物等大气污染物的治理具有重要意义。
(1)煤燃烧产生的烟气中含有(SO2、CO2、PM2.5等),将烟气直接排放到空气中,引发的主要环境问题有 。(填写字母编号)
| A.温室效应 | B.酸雨 | C.粉尘污染 | D.水体富营养化 |
二氧化碳与石灰石浆液反应得到的产物为 。
亚硫酸氢钙被足量氧气氧化生成硫酸钙的化学方程式为 。
(2)有人提出了一种利用氯碱工业产品治理含二氧化硫废气的方法,工艺流程如下:
 工业生产中,步骤③的反应条件为 。
工业生产中,步骤③的反应条件为 。该工艺中物质D可以作为原料循环利用,它的化学式为 。
写出步骤②反应的离子方程式 。
(3)汽车尾气中含有的氮氧化物(NOx)能形成酸雨,写出NO2转化为HNO3的化学方程式 。当尾气中空气不足时,NOX在催化转化器中被还原成N2排出,写出NO被CO还原的化学方程式_ 。
(4)工业上常用Na2CO3溶液处理氮的氧化物。
已知:NO不能与Na2CO3溶液反应
NO + NO2 + Na2CO3 = 2NaNO2 + CO2
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
现用足量的Na2CO3溶液完全吸收NO和NO2的混合气体8.96L,混合气体中NO和NO2的体积比为1:3,则吸收过程中产生气体在标准状况下的体积为 。
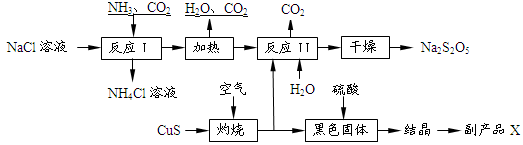
 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。 3Fe(s) +4CO2 (g) ΔH3
3Fe(s) +4CO2 (g) ΔH3