题目内容
一个体重50kg的健康人含铁元素2g。这2g铁以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4).服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)人体中经常进行Fe2+ Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
Fe3+的转化,在过程A中,Fe2+被___________,;“服用维生索C可使食物中的Fe3+转化为Fe2+”这句话指出,维生素C在这一反应过程中做______剂。
(2)测定绿矾(FeSO4·7H2O)产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时发生反应的离子方程式为: 。
②判断此滴定实验达到终点的方法是 。
【答案】
(1)氧化、 还原
(2)①5Fe2++MnO4—+8H+=5Fe3++Mn2++4H2O
②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
【解析】
试题分析:(1)Fe的化合价升高,所以Fe2+被氧化;Fe3+转化为Fe2+,作氧化剂,则维生素C作还原剂。
(2)MnO4—氧化Fe2+,根据化合价升降法可写出离子方程式;滴定达到终点时,Fe2+完全反应,滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色。
考点:本题考察氧化还原反应和氧化还原滴定及离子方程式的书写。

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
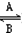 Fe3+的转化,A中Fe2+做
Fe3+的转化,A中Fe2+做