题目内容
(2013?邯郸模拟)一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在.正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁.服用维生素C,可使食物中Fe3+还原成Fe2+,有利于人体吸收.
(1)在人体中进行Fe2+
Fe3+的转化时,②中的Fe3+作
(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(1)在人体中进行Fe2+
| ① | ② |
氧化
氧化
剂;(2)“服用维生素C,可使食物中的Fe3+还原成Fe2+”这句话指出,维生素C在这一反应中作
还原
还原
剂,具有还原
还原
性.(3)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
Fe+2H+═Fe2++H2↑
Fe+2H+═Fe2++H2↑
.分析:(1)②中Fe元素的化合价降低;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气.
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气.
解答:解:(1)②中Fe元素的化合价降低,则,②中的Fe3+作氧化剂,故答案为:氧化;
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,所以维生素C作还原剂,具有还原性,故答案为:还原;还原;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气,该离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
(2)使食物中的Fe3+还原成Fe2+,Fe元素的化合价降低,则维生素C中某元素的化合价升高,所以维生素C作还原剂,具有还原性,故答案为:还原;还原;
(3)铁粉在人体胃酸的作用下转化成亚铁盐,还生成氢气,该离子反应为Fe+2H+═Fe2++H2↑,故答案为:Fe+2H+═Fe2++H2↑.
点评:本题考查氧化还原反应,为高考常考考点,明确反应中元素的化合价变化是解答的关键,侧重基本概念的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
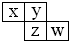 (2013?邯郸模拟)X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若W原子的最外层电子数是内层电子总数的
(2013?邯郸模拟)X、Y、Z、W均为短周期元素,它们在周期表中位置如图所示,若W原子的最外层电子数是内层电子总数的