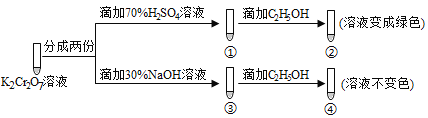
题目内容
【题目】W、X、Y、Z、N是短周期元素,它们的核电荷数依次增大。
元素 | 元素性质或原子结构 |
W | 单质在氯气中燃烧,产生苍白色火焰 |
X | 在Y的上一周期,原子核外s能级上的电子总数与p能级上的电子总数相等 |
Y | 元素的离子半径在该周期中最小 |
Z | 原子核外p能级上的电子总数比s能级上的电子总数多2 |
N | 最外层电子数比次外层电子数少1 |
(1)W单质的化学式为_______,Z元素原子核外有_________个原子轨道填充了电子。
(2)Y、Z和N三种元素第一电离能由大到小的顺序为____________(填元素符号),写出Y3+在过量氨水中反应的离子方程式 ____________。
(3)用电子式表示X与W构成的化合物的形成过程________。
(4)Z元素原子共有________种不同运动状态的电子。
【答案】H2 8 Cl>Si>Al Al3++3NH3. H2O=Al(OH)3 ↓+3NH4+ ![]() 14
14
【解析】
W元素的单质在氯气中燃烧,产生苍白色火焰可知W是H元素,X在Y的上一周期,原子核外s能级上的电子总数与p能级上的电子总数相等,则X核外电子排布是1s22s22p4,X是O元素;Y元素的离子半径在该周期中最小,则Y是Al元素;Z原子原子核外p能级上的电子总数比s能级上的电子总数多2,则Z核外电子排布式是1s22s22p63s23p2,Z是Si元素,N最外层电子数比次外层电子数少1,则N核外电子排布是2、8、7,N是Cl元素,然后根据物质的元素组成及物质结构分析解答。
根据上述分析可知:W是H,X是O,Y是Al,Z是Si,N是Cl元素。
(1)W单质的化学式为H2,Z是Si,是14号元素,核外电子排布式是1s22s22p63s23p2,s轨道数是1,p轨道数目是3,在Si原子最外层的2p轨道上有2个轨道上有电子,而且成单排列,自旋方向相同,所以Si元素原子核外有1+1+3+1+2=8个原子轨道填充了电子。
(2)Y、Z和N三种元素分别是Al、Si、Cl,元素的非金属性越强,原子半径越小,第一电离能就越大,元素的非金属性Cl>Si>Al,所以这三种元素第一电离能由大到小的顺序为Cl>Si>Al。Al3+与过量氨水反应产生Al(OH)3沉淀和NH4+,反应的离子方程式为:Al3++3NH3. H2O=Al(OH)3 ↓+3NH4+。
(3)H原子核外有1个电子,O元素的原子最外层有6个电子,O原子与2个H原子形成2个共价键,使分子中每个原子都达到稳定结合,用电子式表示H2O的形成过程为:![]() 。
。
(4)原子核外有多少电子,则元素原子核外就有多少不同运动状态的电子,Si是14号元素,所以Si元素原子共有14种不同运动状态的电子。

 阅读快车系列答案
阅读快车系列答案【题目】为了纪念元素周期表诞生150周年,联合国将2019年定为“国际化学元素周期表年”。回答下列问题:
(1)Ag与Cu在同一族,则Ag在周期表中_____(填“s”、“p”、“d”或“ds”)区。[Ag(NH3)2]+中Ag+空的5s轨道和5p轨道以sp杂化成键,则该配离子的空间构型是_____。
(2)表中是Fe和Cu的部分电离能数据:请解释I2(Cu)大于I2(Fe)的主要原因:______。
元素 | Fe | Cu |
第一电离能I1/kJ·mol-1 | 759 | 746 |
第二电离能I2/kJ·mol-1 | 1561 | 1958 |
(3)亚铁氰化钾是食盐中常用的抗结剂,其化学式为K4[Fe(CN)6]。
①CN-的电子式是______;1mol该配离子中含σ键数目为______。
②该配合物中存在的作用力类型有______(填字母)。
A.金属键 B.离子键 C.共价键 D.配位键 E.氢键 F.范德华力
(4)MnO的熔点(1660℃)比MnS的熔点(1610℃)高,其主要原因是________。
(5)第三代太阳能电池利用有机金属卤化物碘化铅甲胺(CH3NH3PbI3)半导体作为吸光材料,CH3NH3PbI3具有钙钛矿(AMX3)的立方结构,其晶胞如图所示。

①AMX3晶胞中与金属阳离子(M)距离最近的卤素阴离子(X)形成正八面体结构,则M处于_______位置,X处于______位置(限选“体心”、“顶点”、“面心”或“棱心”进行填空)。
③CH3NH3PbI3晶体的晶胞参数为a nm,其晶体密度为dg·cm-3,则阿伏加德罗常数的值NA的计算表达式为_________。
【题目】废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法回收WC和制备Co2O3的工艺流程简图如下:
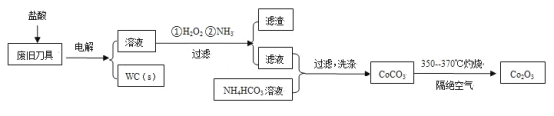
已知:在上述流程中,各种金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Fe2+ | Co2+ |
开始沉淀的pH | 1.9 | 7.0 | 6.5 |
沉淀完全的pH | 3.2 | 9.0 | 9.4 |
回答下列问题:
(1)以废旧刀具作阳极,不锈钢作阴极,盐酸为电解质溶液。电解时阳极的电极反应有:Co-2e-=Co2+和______。
(2)通入氨气的目的是调节溶液的pH,除去铁元素。由表中的数据可知,理论上可选择的pH的范围是_______。
(3)生成CoCO3的离子方程式是________。
(4)实验测得NH4HCO3溶液显碱性。制备CoCO3时,不能将滤液加入NH4HCO3溶液中,原因是_______。
(5)已知:Ksp(CoCO3)=1.4×10-13,Ksp(CoC2O4)=6.3×10-8。若仅从沉淀转化角度考虑,在0.01mol/L Na2C2O4溶液中加入CoCO3固体能否转化为CoC2O4沉淀?通过计算说明:_________。
(6)洗涤CoCO3不充分对最终产品纯度并无影响,但在焙烧时会造成环境污染,主要原因是____。
(7)CoCO3生成Co2O3的化学方程式是_________。