题目内容
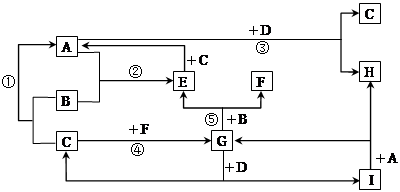
(14分)已知由短周期常见元素形成的纯净物A、B、C、D、E、F、X转化关系如下图所示,B、X为单质,D常温下为无色液体,A、B含同一种元素。(某些产物可能略去)

请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。

③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。

请回答下列问题:
(1)若E是有色气体,F是一元强酸,反应①是工业制备F的第一步反应。
①写出A与X反应的化学方程式: 。
②有人认为“浓H2SO4可以干燥气体E”。某同学为了验证该观点是否正确,用下图装置进行实验。实验过程中,浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,由此你得出的结论是 。

③已知常温下1 mol气体E发生反应③放出46kJ热量,写出气体E与H2O反应的热化学方式 。
④在常温下,向V1L pH=a的A溶液中加入V2L pH=b的盐酸,且a+b=14,若反应后溶液的pH<7,则V1和V2的关系为V1 V2(填>、<、无法确定),所得溶液中各种离子的浓度由大到小的顺序可能是 。(写出一种情况即可)
(2)若E为无色无味气体,F是二元弱酸。
①E的电子式为 ;
②将少量气体E通入氢氧化钡溶液中得不溶物G,G的KSP=8.1×10-9。现将该沉淀放入0.1mol/L的BaCl2溶液中,其KSP ,(填:增大、减小或不变),此时,组成不溶物G的阴离子在溶液中的浓度为 mol/L。
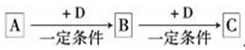
(1)①4NH3+5O2 4NO+6H2O
4NO+6H2O
②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = -138 kJ/mol
④ < ,c(Cl-) >c(Na+) >c(H+) >c(OH-)
(2)①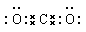 (1分) ②不变(1分) ;8.1×10-8
(1分) ②不变(1分) ;8.1×10-8
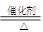 4NO+6H2O
4NO+6H2O②NO2能溶于浓硫酸中,浓硫酸不能干燥NO2
③3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = -138 kJ/mol
④ < ,c(Cl-) >c(Na+) >c(H+) >c(OH-)
(2)①
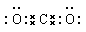 (1分) ②不变(1分) ;8.1×10-8
(1分) ②不变(1分) ;8.1×10-8(1)D常温下为无色液体,则D可能是水。若E是有色气体,F是一元强酸,则E是NO2,F是硝酸。反应①是工业制备F的第一步反应。所以A是氨气,X是氧气,C是NO,B是氮气。
①该反应是氨的催化氧化,方程式为4NH3+5O2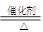 4NO+6H2O。
4NO+6H2O。
②浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,这说明NO2能溶解在浓硫酸中,因此浓硫酸不能干燥NO2气体。
③根据题意可知,该反应的热化学方程式为3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = -138 kJ/mol。
④盐酸中氢离子浓度是10-bmol/L,氨水中OH-的浓度是10a-14mol/L=10-bmol/L。由于氨水是弱碱,所以氨水的浓度一定大于10-bmol/L,反应后溶液显酸性所以氨水的体积一定小于盐酸的体积。由于二者恰好反应时,溶液显酸性,盐酸过量时液显酸性,所以离子浓度大小关系是c(Cl-) >c(NH4+) >c(H+) >c(OH-)或c(Cl-) >c(H+)>cNH4+) >c(OH-)。
(2)若E为无色无味气体,F是二元弱酸,则E是CO2,F是碳酸。
①CO2分子中含有碳氧双键,电子式为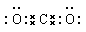 。
。
②溶度积常数只与温度有关系,所以在温度不变的条件下,溶度积常数不变。G是碳酸钡,当钡离子浓度是0.1mol/L时,CO32-浓度是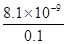 =8.1×10-8mol/L。
=8.1×10-8mol/L。
①该反应是氨的催化氧化,方程式为4NH3+5O2
 4NO+6H2O。
4NO+6H2O。②浓H2SO4中未发现有气体逸出,且浓H2SO4由无色变为红棕色,这说明NO2能溶解在浓硫酸中,因此浓硫酸不能干燥NO2气体。
③根据题意可知,该反应的热化学方程式为3 NO2(g)+ H2O(l)= 2HNO3(aq)+ NO(g); △H = -138 kJ/mol。
④盐酸中氢离子浓度是10-bmol/L,氨水中OH-的浓度是10a-14mol/L=10-bmol/L。由于氨水是弱碱,所以氨水的浓度一定大于10-bmol/L,反应后溶液显酸性所以氨水的体积一定小于盐酸的体积。由于二者恰好反应时,溶液显酸性,盐酸过量时液显酸性,所以离子浓度大小关系是c(Cl-) >c(NH4+) >c(H+) >c(OH-)或c(Cl-) >c(H+)>cNH4+) >c(OH-)。
(2)若E为无色无味气体,F是二元弱酸,则E是CO2,F是碳酸。
①CO2分子中含有碳氧双键,电子式为
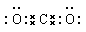 。
。②溶度积常数只与温度有关系,所以在温度不变的条件下,溶度积常数不变。G是碳酸钡,当钡离子浓度是0.1mol/L时,CO32-浓度是
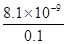 =8.1×10-8mol/L。
=8.1×10-8mol/L。
练习册系列答案
 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案
相关题目
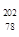 Pt的说法正确的是
Pt的说法正确的是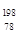 Pt的质子数相同,互称为同位素
Pt的质子数相同,互称为同位素