题目内容
【题目】如图所示实验装置可用于制取乙炔. 
请填空:
(1)A管的作用是 , 制取乙炔的化学方程式是 .
(2)乙炔通入KMnO4酸性溶液中观察到的现象是 , 乙炔发生了反应.
(3)乙炔通入溴水的CCl4溶液中观察到的现象是 .
(4)为了安全,点燃乙炔前应 , 乙炔燃烧时的实验现象是 .
【答案】
(1)调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑
(2)高锰酸钾溶液褪色;氧化
(3)溴的四氯化碳溶液褪色
(4)检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟
【解析】解:(1)图示装置可通过调节A管的高度,控制反应的发生和停止:将A管提高,右管中水面上升,与电石接触发生反应;将A管降低,右管中水面下降,水与电石脱离接触,反应停止,则制取乙炔的化学反应方程式为CaC2+2H2O→Ca(OH)2+CH≡CH↑,
故答案为:调节水面的高度来控制反应的发生和停止;CaC2+2H2O→Ca(OH)2+CH≡CH↑;(2)乙炔容易被高锰酸钾氧化,使高锰酸钾褪色,故答案为:高锰酸钾溶液褪色;氧化;(3)乙炔能够和溴水发生加成反应,导致溴的四氯化碳溶液褪色,故答案为:溴的四氯化碳溶液褪色;(4)乙炔燃烧的化学方程式为 2CH≡CH+5O2 ![]() 4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,故答案为:检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟.
4CO2+2H2O;乙炔中含碳的质量分数较大,燃烧时火焰明亮并伴有浓烈的黑烟;乙炔点燃前必须检验其纯度,故答案为:检查乙炔的纯度;明亮火焰并伴有浓烈的黑烟.
(1)通过图中A管,可以控制反应的开始和停止;实验室通过电石与水的反应制取乙炔;(2)乙炔能使酸性高锰酸钾溶液褪色,发生了氧化反应;(3)关键乙炔与溴发生加成反应进行判断;(4)乙炔是可燃性气体,可燃性气体在点燃前必须检验其纯度,以免发生爆炸;因乙炔中含碳的质量分数较大,在燃烧时火焰明亮并伴有浓烈的黑烟.

 阅读快车系列答案
阅读快车系列答案【题目】利用铜萃取剂M,通过如下反应实现铜离子的富集:
(1)X难溶于水、易溶于有机溶剂,其晶体类型为。
(2)X中以sp2杂化、sp3杂化的原子的第一电离能由大到小顺序为。
(3)上述反应中断裂和生成的化学键有(填序号)。
a.离子键 b.配位键 c.金属键 d.范德华力 e.共价键
(4)M与W(分子结构如图)相比,M的水溶性小,更利于Cu2+的萃取。M水溶性小的主要原因是。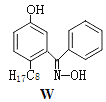
(5)硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒等功效。取5.0 g胆矾样品逐渐升高温度使其分解,分解过程的热重如下表。回答下列问题:
温度范围/℃ | 固体质量/g |
258~680 | 3.20 |
680~1000 | 1.60 |
1000以上 | 1.44 |
下图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子)。
①该温度是。
②铜原子的配位数是。