题目内容
7.实验室可以用高锰酸钾和浓盐酸反应制取氯气,反应的化学方程式如下:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(1)该反应中的氧化剂是KMnO4,氧化产物是Cl2
(2)氧化剂与还原剂之比是1:5
(3)如反应中转移了5mol电子,则产生的气体在标准状况下体积为56升.
分析 由方程式可知,反应中Mn元素化合价由+7价降低到+2价,被还原,KMnO4为氧化剂,Cl元素化合价由-1价升高到0价,被氧化,HCl为还原剂,结合化合价的变化以及反应的方程式可计算转移电子的数目.
解答 解:(1)Mn元素化合价由+7价降低到+2价,KMnO4为氧化剂;反应中Cl元素化合价由-1价升高到0价,HCl为还原剂,被氧化得到氧化产物为Cl2,故答案为:KMnO4;Cl2;
(2)反应中KMnO4为氧化剂,HCl为还原剂,16molHCl中只有10mol被氧化,则氧化剂与还原剂之比是2:10=1:5;
故答案为:1:5;
(3)Mn元素化合价由+7价降低到+2价,Cl元素化合价由-1价升高到0价,
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O 转移电子
5×22.4L 10
VL 5mol
则V=56L,
故答案为:56.
点评 本题考查氧化还原反应,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度认识氧化还原反应的相关概念和物质的性质,难度不大.

练习册系列答案
相关题目
17.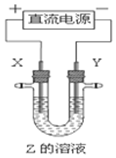 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 外加电流的阴极保护法中,Y是待保护金属 |
18.已知氧化性Fe3+>Cu2+>Fe2+.现有一包铁粉和铜粉混合粉末,某实验小组为了确定其组成,利用1.2mol•L-1的FeCl3溶液(其他用品略),与混合粉末反应,实验结果如下(假定反应前后溶液体积不变):
分析表中数据,下列结论不正确的是( )
| 组别 | ① | ② | ③ | ④ |
| V[FeCl3(aq)]/mL | 50 | 50 | 50 | 50 |
| 混合粉末质量/g | 1.2 | 2.4 | 3.6 | 4.8 |
| 反应后剩余固体质量/g | 0 | 0.64 | 1.92 | 3.12[ |
| A. | 第①组反应后溶液中剩余c(Fe3+)=0.4 mol•L-1 | |
| B. | 第②、③组剩余固体全是铜 | |
| C. | 第④组的滤液中c(Fe2+)=2.0 mol•L-1 | |
| D. | 原混合粉末中n(Fe):n(Cu)=1:1 |
15.三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.则下列说法正确的是( )
| A. | 反应过程中,被氧化与被还原的元素的物质的量之比为2:1 | |
| B. | NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 | |
| C. | 一旦NF3泄漏,用石灰水溶液喷淋的方法可以减少污染 | |
| D. | 若反应中转移的电子数目为6.02×1023,生成22.4L NO气体 |
2.核内中子数为N的R2+,质量数为A,则ngR2+所含电子的物质的量是( )
| A. | $\frac{n(A-N+8)}{A+16}$mol | B. | $\frac{n(A-N+2)}{A}$ mol | C. | $\frac{n(A-N+8)}{A+8}$mol | D. | $\frac{n(A-N-2)}{A}$ mol |
12.下列与有机物的结构、性质有关的叙述正确的是( )
| A. | 苯、甲苯均不能使酸性KMnO,溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C4H10有三种同分异构体 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是得到更多的乙烯、丙烯等气态短链烃 |
19.已知:CO(g)、H2(g)、CH3OH(l)的燃烧热分别为-283.0kJ/mol、-285.8kJ/mol、-726.5kJ/mol,则反应CO(g)+2H2(g)=CH3OH(l)的△H为( )
| A. | -128.1kJ/mol | B. | -1295.3kJ/mol | C. | -157.7kJ/mol | D. | +157.7kJ/mol |
16.下列说法正确的是( )
| A. | 将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中必有铁 | |
| B. | CO2和SO2混合气体分别通入BaCl2溶液、Ba(NO3)2溶液中,最终都有沉淀生成 | |
| C. | 钠、镁着火时,不可用泡沫灭火器灭火 | |
| D. | 用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离 |
17.下列设计的实验方案能达到实验目的是( )
| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸或醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |