题目内容
17.下列设计的实验方案能达到实验目的是( )| A. | 工业上制取漂白粉:向澄清石灰水中通入足量的Cl2 | |
| B. | 验证醋酸是弱电解质:常温下测定0.1 mol•L-1醋酸或醋酸钠溶液的pH | |
| C. | 探究FeCl3和KI溶液反应限度:向5mL0.1 mol•L-1KI溶液中加入0.1 mol•L-1FeCl3溶液1mL,振荡,加苯萃取后,向水层中加入5滴KSCN溶液,观察实验现象 | |
| D. | 检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,再与银氨溶液混合加热,观察实验现象 |
分析 A.氯气与石灰乳制备漂白粉;
B.测定0.1 mol•L-1醋酸的pH>1或醋酸钠溶液的pH>7,可知对应酸的弱酸;
C.KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2;
D.检验葡萄糖,应在碱性溶液中.
解答 解:A.氢氧化钙的溶解度较小,则工业上制取漂白粉是向石灰乳中通入足量的Cl2,故A错误;
B.测定0.1 mol•L-1醋酸的pH>1或醋酸钠溶液的pH>7,可验证醋酸是弱电解质,故B正确;
C.KI溶液和FeCl3溶液发生氧化还原反应生成Fe2+和I2,反应的离子方程式为2Fe3++2I-═2Fe2++I2,反应后的溶液中加入苯,如有机层呈紫红色,则说明生成碘,向含Fe3+的溶液中滴加几滴KSCN溶液呈血红色,这是Fe3+的特殊反应,所以可滴加KSCN溶液,溶液显血红色,发生Fe3++3SCN-═Fe(SCN)3,就说明Fe3+没有反应完(或KI和FeCl3的反应有一定的限度),故C正确;
D.检验蔗糖水解生成的葡萄糖:蔗糖溶液在稀硫酸存在下水浴加热一段时间后,然后加碱至碱性再与银氨溶液混合加热,观察实验现象,可检验,故D错误;
故选BC.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质制备、弱电解质判断、反应限度及物质检验等,把握反应原理及实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
8.化学与社会、生产、生活紧切相关,下列说法正确的是( )
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较低,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和碳酸钠.
①光导纤维具有很强的导电能力,所以大量用于制造通信光缆
②食盐可作为调味品和防腐剂
③明矾常用作净水剂,是因为它具有消毒杀菌的作用
④SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾
⑤氨常用作制冷剂,是因为其沸点较低,很容易液化
⑥将过量CO2气体通入C6H5ONa溶液中可生成C6H5OH和碳酸钠.
| A. | ①②④⑤ | B. | ②④ | C. | ②④⑤ | D. | ②③④⑥ |
5. 向盛有100mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示.则原HCl物质的量浓度是( )
向盛有100mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示.则原HCl物质的量浓度是( )
 向盛有100mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示.则原HCl物质的量浓度是( )
向盛有100mL HCl溶液的烧杯中加入一定量的铝土矿(含Al2O3、Fe2O3、SiO2)样品,充分反应后过滤,向滤液中加入5mol/L的NaOH溶液,产生沉淀的量与所加NaOH溶液的体积的关系如下图所示.则原HCl物质的量浓度是( )| A. | 4mol/L | B. | 3mol/L | C. | 2mol/L | D. | 1mol/L |
12.下列有关实验原理或实验操作正确的是( )
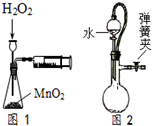

| A. | 将氯化铁固体溶于稀盐酸配制FeCl3溶液 | |
| B. | 称取4.0gNaOH,放入100mL容量瓶中,加水稀释,配制1.0mol•L-1的NaOH溶液 | |
| C. | 利用图1装置定量测定H2O2的分解速率 | |
| D. | 如图2所示,关闭弹簧夹检查装置的气密性 |
9.了解一些安全生活、生产常识,有助于自身安全及事故救助.下列有关安全处理不合理的是( )
| A. | 木材厂、纺织厂、面粉厂都必须严禁烟火 | |
| B. | 炒菜时锅中的油着火时可立即盖上锅盖 | |
| C. | 运输液氯的罐车泄漏时应逆风往高处跑 | |
| D. | 化学品仓库保存的金属钠着火时可用水灭 |
6.以下三组溶液:①汽油和硫酸钠溶液 ②42%的乙醇溶液 ③氯化钠和碘的水溶液分离以上各混合液的方法依次是( )
| A. | 分液、萃取、蒸馏 | B. | 萃取、蒸馏、分液 | C. | 分液、蒸馏、萃取 | D. | 蒸馏、萃取、分液 |
7.根据有关化学原理,下列判断正确的是( )
| A. | 常温下,弱酸A的浓度小于弱酸B,则A的电离程度一定大于B | |
| B. | 晶体A易溶于CCl4则A一定是分子晶体 | |
| C. | 在溶液中单质A能置换出金属B,则单质A可以是金属也可以是非金属 | |
| D. | 能量低的状态更稳定,则自然界的物质都以能量最低的状态存在 |