题目内容
17.常温下,某溶液中水的电离度a=10-10/55.5(%),该溶液的pH可能是( )| A. | 12 | B. | 10 | C. | 4 | D. | 3 |
分析 1L水的质量约为1000g,根据n=$\frac{m}{M}$计算出水的物质的量,再根据该温度下水的电离度计算出水电离出的氢离子浓度,从而可判断溶液酸碱性,最后通过讨论判断该溶液的酸碱性及pH.
解答 解:常温下1L水的质量为1000g,其物质的量为:$\frac{1000g}{18g/mol}$≈55.5mol,
则该温度下水电离的氢离子浓度为:c(H+)=$\frac{55.5mol×\frac{1{0}^{-10}}{55.5}%}{1L}$=1×10-12mol/L,
说明水的电离受到了抑制,因此该溶液可能是酸性溶液也可能是碱性溶液,
该溶液若为酸性溶液,则溶液中氢离子浓度为:c(H+)=$\frac{1{0}^{-14}}{1{0}^{-12}}$mol/L=1×10-2mol/L,其pH=2;
若为碱性溶液:溶液中的氢离子全部来源于水的电离,因此c(H+)为1×10-12mol/L,溶液的pH=12,
故选A.
点评 本题考查了溶液pH的计算,题目难度中等,正确计算出水电离的氢离子浓度为解答关键,注意掌握水的电离及其影响因素,能够正确计算溶液的pH.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
7.为除去括号内杂质,下列有关试剂和操作方法不正确的是( )
| A. | 溴苯(苯):蒸馏 | B. | 乙醇(乙酸):KOH溶液,分液 | ||
| C. | 乙烷(乙烯):溴水,洗气 | D. | 苯(溴):稀NaOH溶液,分液 |
12.现有几个离子反应:
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
①Cr2O72-+14H++6Cl-═2Cr3++3Cl2↑+7H2O
②2Fe2++Br2═2Fe3++2Br-
③2Fe3++SO2+2H2O═2Fe2++SO42-+4H+
下列有关性质的比较中正确的是( )
| A. | 氧化性:Cr2O72->Cl2>Fe3+ | B. | 氧化性:Cl2>Br2>Cr2O72- | ||
| C. | 还原性:SO2<Fe2+<Br- | D. | 还原性:Cl->Cr3+>Fe2+ |
9.已知Cu(NO3)2受热分解的化学方程式为:2Cu(NO3)2═2CuO+4NO2↑+O2↑,某人将少量的Cu(NO3)2固体放入试管中加热,然后用带火星的木条放入试管中,木条复燃,则下列说法正确的是( )
| A. | NO2能支持燃烧 | |
| B. | NO2不能支持燃烧 | |
| C. | 木条复燃是因为硝酸铜分解产生了氧气的缘故 | |
| D. | 不能判断NO2是否支持燃烧 |
6.下列说法中,正确的是( )
| A. | 合成纤维、人造纤维可统称为化学纤维 | |
| B. | 酚醛树脂和聚氯乙烯都是热固性塑料 | |
| C. | 合成纤维“六大纶”中吸湿性最好的是锦纶 | |
| D. | 高分子材料可分为天然高分子材料和合成高分子材料两大类 |
7.目前,我国重点城市空气质量日报的监测项目中不包括( )
| A. | 二氧化硫(SO2) | B. | 二氧化碳(CO2) | C. | 二氧化氮(NO2) | D. | 总悬浮颗粒物(TSP) |
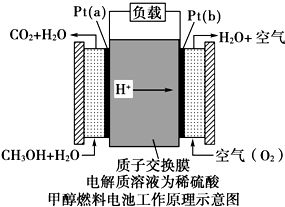 科学家预言,燃料电池将是21世纪获得电能的重要途径.
科学家预言,燃料电池将是21世纪获得电能的重要途径.