题目内容
6.下列溶液经加热蒸干,再高温灼烧后仍能得原物质的是( )| A. | NaHCO3 | B. | FeSO4 | C. | FeCl3 | D. | Na2CO3 |
分析 加热蒸干并灼烧的过程中,要注意考虑盐的水解平衡的移动、物质的氧化、物质的分解等情况,氯化铝易水解,碳酸氢镁加热易分解,硫酸亚铁易被氧化.
解答 解:A.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,故A错误;
B.硫酸亚铁溶液在加热过程中易被氧化,故B错误;
C.FeCl3溶液加热时水解生成氢氧化铁和盐酸,盐酸易挥发,生成的氢氧化铁在灼烧时生成氧化铁,故C错误;
D.碳酸钠在溶液在加热时水解得到碳酸氢钠与氢氧化钠,但氢氧化钠难挥发,最后得到的固体为Na2CO3,故D正确.
故选D.
点评 本题综合考查物质的性质,侧重于水解、分解等知识,为高频考点,题目难度不大,注意相关物质的性质的掌握.

练习册系列答案
相关题目
16.用石墨作电极,电解1mol/L下列物质的溶液,则电解前后溶液的pH保持不变的是( )
| A. | HCl | B. | NaOH | C. | CuSO4 | D. | KNO3 |
1.将白醋、食用油、食盐、酒精分别放入水中,不能形成溶液的是( )
| A. | 白醋 | B. | 食用油 | C. | 食盐 | D. | 酒精 |
10.氢气是一种清洁能源.用甲烷制取氢气的两步反应的能量变化如下图所示:
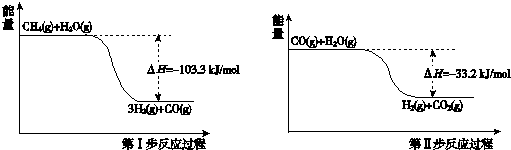
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol.
(2)第II步为可逆反应.在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的起始浓度为3.0mol/L,达到化学平衡状态后,测得CO2的浓度为1.2mol/L,则此反应的平衡常数为1,随着温度升高该反应的化学平衡常数的变化趋势是变小.
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是bc(填序号).
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b.单位时间内断开amol H-H键的同时断开2a mol O-H键
c.反应容器中放出的热量不再变化
d.混合气体的密度不再发生变化
e.混合气体的压强不再发生变化
(4)某温度下,第Ⅱ步反应的平衡常数为K=$\frac{1}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示.下列判断不正确的是CD.
A.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D.平衡时,乙中H2O的转化率大于25%

(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol.
(2)第II步为可逆反应.在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的起始浓度为3.0mol/L,达到化学平衡状态后,测得CO2的浓度为1.2mol/L,则此反应的平衡常数为1,随着温度升高该反应的化学平衡常数的变化趋势是变小.
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是bc(填序号).
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b.单位时间内断开amol H-H键的同时断开2a mol O-H键
c.反应容器中放出的热量不再变化
d.混合气体的密度不再发生变化
e.混合气体的压强不再发生变化
(4)某温度下,第Ⅱ步反应的平衡常数为K=$\frac{1}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示.下列判断不正确的是CD.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2O)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D.平衡时,乙中H2O的转化率大于25%
 2,4,4-三甲基己烷,
2,4,4-三甲基己烷,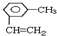 .
.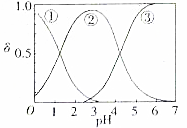 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.