题目内容
10.氢气是一种清洁能源.用甲烷制取氢气的两步反应的能量变化如下图所示: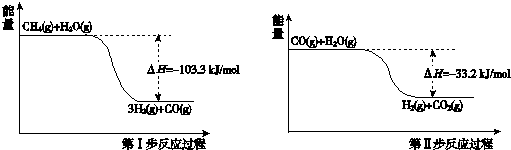
(1)甲烷和水蒸气反应生成二氧化碳和氢气的热化学方程式是CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5kJ/mol.
(2)第II步为可逆反应.在800℃时,若CO的起始浓度为2.0mol/L,水蒸气的起始浓度为3.0mol/L,达到化学平衡状态后,测得CO2的浓度为1.2mol/L,则此反应的平衡常数为1,随着温度升高该反应的化学平衡常数的变化趋势是变小.
(3)在恒温恒容密闭容器中进行的第II步反应,下列说法中能表示达到平衡状态的是bc(填序号).
a.四种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
b.单位时间内断开amol H-H键的同时断开2a mol O-H键
c.反应容器中放出的热量不再变化
d.混合气体的密度不再发生变化
e.混合气体的压强不再发生变化
(4)某温度下,第Ⅱ步反应的平衡常数为K=$\frac{1}{9}$.该温度下在甲、乙、丙三个恒容密闭容器中投入H2O(g)和CO(g),其起始浓度如下表所示.下列判断不正确的是CD.
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2O)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO)/mol/L | 0.010 | 0.010 | 0.020 |
B.平衡时,甲中和丙中H2O的转化率均是25%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.015mol/L
D.平衡时,乙中H2O的转化率大于25%
分析 (1)根据第一步反应过程可以得出:①CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3KJ/mol;
根据第二步反应过程可以得出:②CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol;
根据盖斯定律将①+②可得甲烷和水蒸气反应生成二氧化碳和氢气的反应,据此书写热化学方程式;
(2)根据化学平衡“三行式”来计算平衡时各物质的浓度,平衡常数等于生成物浓度系数次幂之积除以反应物浓度系数次幂之积,根据温度对平衡移动的影响判断平衡常数的变化;
(3)第II步反应为CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol,
a.四种物质的浓度比与化学方程式中各物质的化学计量数之比的关系与起始量有关,不能说明反应是否处于平衡状态;
b.单位时间内断开amol H-H键的同时断开2a mol O-H键,说明正逆反应速率相等;
c.随着反应的进行,伴随着能量的变化,当反应容器中放出的热量不再变化,说明反应处于平衡状态;
d.该反应的反应前后气体的质量和容器的体积均不变,所以混合气体的密度不随着反应的进行而发生变化;
e.该反应的反应前后气体的物质的量不变,所以混合气体的压强不随着反应的进行而发生变化;
(4)反应H2O(g)+CO(g)?H(g)+CO2(g)中,反应物和生成物的体积相等,压强对平衡移动无影响,从等效平衡的角度结合浓度对平衡的影响分析.
解答 解:(1)根据第一步反应过程可以得出:CH4(g)+H2O(g)=3H2(g)+CO(g),△H=-103.3KJ/mol;
根据第二步反应过程可以得出:CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol;
根据盖斯定律,上下两式相加可得:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol,
故答案为:CH4(g)+2H2O(g)=4H2(g)+CO2(g)△H=-136.5 kJ/mol;
(2)设CO的平衡转化量为x,
CO(g)+H2O(g)=H2(g)+CO2(g)
初始浓度:2.0 3.0 0 0
变化浓度:1.2 1.2 1.2 1.2
平衡浓度:0.8 1.8 1.2 1.2
平衡常数K=$\frac{1.2×1.2}{0.8×1.8}$=1,该反应为放热反应,所以随着温度的升高平衡逆向移动,平衡常数变小,
故答案为:1;变小.
(3)第II步反应为CO(g)+H2O(g)=H2(g)+CO2(g),△H=-33.2KJ/mol,
a.四种物质的浓度比与化学方程式中各物质的化学计量数之比的关系与起始量有关,不能说明反应是否处于平衡状态;
b.单位时间内断开amol H-H键的同时断开2a mol O-H键,说明正逆反应速率相等,即反应达到平衡状态;
c.随着反应的进行,伴随着能量的变化,当反应容器中放出的热量不再变化,说明反应处于平衡状态;
d.该反应的反应前后气体的质量和容器的体积均不变,所以混合气体的密度不随着反应的进行而发生变化,所以不能说明反应是否处于平衡状态;
e.该反应的反应前后气体的物质的量不变,所以混合气体的压强不随着反应的进行而发生变化,所以不能说明反应是否处于平衡状态;
故选:bc;
(4)A.丙中浓度最大,甲中浓度最小,浓度越大,反应速率越大,则反应开始时,丙中的反应速率最快,甲中的反应最慢,故A正确;
B. 以甲计算:
H2O(g)+CO(g)?H2(g)+CO2(g)
起始/mol/L:0.01 0.01 0 0
转化/mol/L:x x x x
平衡/mol/L:0.01-x 0.01-x x x
则$\frac{{x}^{2}}{(0.01-x)^{2}}$=$\frac{1}{9}$,x=0.0025,则平衡时甲中的H2O的转化率均是$\frac{0.0025}{0.01}$=25%,由于甲和丙的气体的比值相同,且该反应为前后气体的计量数相同,为等效平衡状态,则丙中H2的转化率也为25%,故B正确;
C.由B计算可知,平衡时,丙中的c(CO2)是甲中的2倍,应为2×0.0025mol/L=0.005mol/L,故C错误;
D.乙与甲相比较,相当于在甲的基础上通入H2O,则水的转化率下降,平衡时,乙中的水的转化率小于25%,故D错误.
故答案为:CD.
点评 本题考查学生热化学方程式的书写以及化学平衡转化率的计算知识,注意知识的积累是关键,难度中等,注意利用三段式法计算,易错点为(4),注意对等效平衡的理解和运用.

| A. | 将苯逐滴滴入浓硝酸和稀硫酸的混合液中,并用沸水浴加热制取硝基苯 | |
| B. | 油脂的提纯中,可将油脂加入浓NaOH 溶液加热,然后过滤,从滤液中可得较纯的油脂 | |
| C. | 将铜丝在酒精灯上加热到红热后,立即伸入无水乙醇中,反复操作多次,可制得乙醛 | |
| D. | 淀粉用酸催化水解后的溶液加入银氨溶液,水浴加热,可看到有银镜出现 |
| A. | NaHCO3 | B. | FeSO4 | C. | FeCl3 | D. | Na2CO3 |
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
(1)生产中为提高反应速率和SO2的转化率,下列措施可行的是A.
A.向装置中充入O2 B.升高温度
C.向装置中充入N2 D.向装置中充入过量的SO2
(2)500℃时,将10mol SO2和5.0mol O2置于体积为2L的恒容密闭容器中,反应中数据如表所示:
| 时间/(min) | 2 | 4 | 6 | 8 |
| n(SO3)/(mol) | 4.2 | 8.0 | 9.4 | 9.4 |
②500℃时该反应的平衡常数K=1636.3.
(3)恒温恒压,通入3mol SO2 和2mol O2及固体催化剂,平衡时容器内气体体积为起始时的90%.保持同一反应温度,在相同容器中,将起始物质的量改为 5mol SO2、3.5mol O2、1mol SO3(g),下列说法正确的是CD.
A.第一次平衡时反应放出的热量为294.9kJ
B.两次平衡SO2的转化率相等
C.两次平衡时的O2体积分数相等
D.第二次平衡时SO3的体积分数等于$\frac{2}{9}$.
 在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(2)能判断该反应是否已达化学平衡状态的依据是bc.
a.容器中压强不变b.混合气体中c(CO)不变c.v正(H2)=v逆(H2O)d.c(CO2)=c(CO)
(3)若 830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”、“等于”)
(4)某温度下,在2L的密闭容器中,加入1molCO2和1molH2充分反应达平衡时,CO平衡浓度为0.25mol/L,试判断此时的温度为830℃.
(5)若在(4)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为1.8mol.
| A. | 增加稀硫酸用量 | B. | 加几滴硫酸铜溶液 | ||
| C. | 用浓硫酸代替稀硫酸 | D. | 用铁片代替铁粉 |
| A. | 同一种原子 | B. | 化学性质不同的氢原子 | ||
| C. | 氢元素 | D. | 物理性质相同的氢原子 |