题目内容
7.浓度均为0.1mol•L-1的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是( )| A. | BaCl2 NaOH NaHCO3 | B. | Na2CO3 MgCl2 H2SO4 | ||
| C. | AlCl3 NH3•H2O NaOH | D. | Ba(OH)2 CaCl2 Na2SO4 |
分析 A、氢氧根离子、碳酸氢根离子、钡离子能够反应生成碳酸钡沉淀;
B、浓度均为0.1mol•L-1的Na2CO3与H2SO4恰好发生反应生成硫酸钠溶液;
C、浓度相等的AlCl3 NH3•H2O NaOH发生反应生成了氢氧化铝沉淀;
D、氢氧化钡与硫酸钠反应生成硫酸钡沉淀、钙离子与氢氧根离子反应生成氢氧化钙微溶物.
解答 解:A、等物质的量NaOH、NaHCO3恰好反应生成碳酸钠和水,BaCl2和碳酸钠前后反应生成碳酸钡沉淀和氯化钠,所以一定有沉淀生成,故A不选;
B、Na2CO3、MgCl2、H2SO4等物质的量混合能生成沉淀只能是碳酸镁,但有硫酸存在,所以不可能生成沉淀,故B选;
C、AlCl3、NH3•H2O、NaOH等物质的量混合,1mol铝离子需要3mol氢氧根离子完全沉淀,根据题意碱不足,所以一定有沉淀生成,故C不选;
D、Ba(OH)2、CaCl2、Na2SO4等物质的量混合可以生成硫酸钡沉淀,所以一定有沉淀生成,故D不选;
故选B.
点评 本题考查了给定量的物质混合时的反应判断,关键是要充分掌握各类物质的化学性质,生成物质在所在环境中的存在判断,题目难度中等.

练习册系列答案
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案
相关题目
15.设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 1mol金刚石晶体中含碳碳键数为2NA | |
| B. | 常温常压下,22.4L的D2、H2组成的气体分子数约为NA | |
| C. | 标准状况下,22.4LSO3中含有的氧原子数约为3 NA | |
| D. | 1molNa2O2与足量CO2反应转移的电子数2NA |
2.下列反应的离子方程式书写正确的是( )
| A. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| B. | 澄清石灰水与少量苏打溶液混合:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| C. | 碳酸钙溶于醋酸:CaCO3+2H+═Ca2++CO2↑+H2O | |
| D. | 氯化亚铁溶液中通入氯气:2Fe2++Cl2═2Fe3++2Cl- |
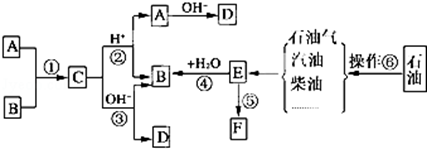
1.如图是一些常见有机物的转化关系,关于反应①~⑫的说法不正确的是( )
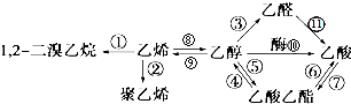

| A. | 有①②⑧三个反应均属于加成反应 | B. | 只有②发生的是加聚反应 | ||
| C. | 总共有4个反应是氧化反应 | D. | 反应④⑤⑥⑦是取代反应 |
8.用下列装置不能达到有关实验目的是( )
| A. | 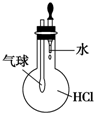 验证HCl的溶解性 | B. | 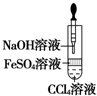 制备Fe(OH)2 | ||
| C. | 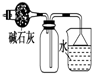 干燥并收集NH3 | D. | 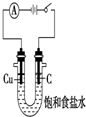 利用电解法制H2和Cl2 |
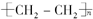 .
. ,写出M在催化剂作用下缩聚为高分子化合物的反应方程式
,写出M在催化剂作用下缩聚为高分子化合物的反应方程式 +(n-1)H2O.另有有机物N在浓硫酸存在下,两分子相互作用生成一种环状酯
+(n-1)H2O.另有有机物N在浓硫酸存在下,两分子相互作用生成一种环状酯 ,则有机物N的结构简式为:
,则有机物N的结构简式为: .M溶液既能和Na反应,又能和NaOH溶液反应,写出M与Na反应的反应方程式:
.M溶液既能和Na反应,又能和NaOH溶液反应,写出M与Na反应的反应方程式: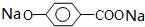 +H2↑.
+H2↑.