题目内容
为了减少温室气体排放,目前工业上采用CO2与H2在催化剂作用下反应制备重要化工原料CH3OH的工艺:CO2(g)+3H2(g) CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
根据题目回答下列问题:
(1)0~3 s内用H2表示的平均反应速率是____________;
(2)平衡时CO2的转化率是____________。
(3)能说明反应已达平衡状态的是____________。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)一定能使该反应的反应速率增大的措施有 _________。
A.及时分离出产物
B.适当降低温度
C.其他条件不变,增大CO2浓度
 CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:
CH3OH(g) +H2O(g)。为了探究其反应原理进行如下实验,在2L恒容的密闭容器内250℃条件下,测得n(CO2)随时间的变化情况如下表:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(CO2)(mol) | 0.40 | 0.35 | 0.31 | 0.30 | 0.30 | 0.30 |
(1)0~3 s内用H2表示的平均反应速率是____________;
(2)平衡时CO2的转化率是____________。
(3)能说明反应已达平衡状态的是____________。
A.υ(H2)=3υ(CO2) B.容器内压强保持不变
C.υ逆(CO2)=υ正(CH3OH) D.容器内密度保持不变
(4)一定能使该反应的反应速率增大的措施有 _________。
A.及时分离出产物
B.适当降低温度
C.其他条件不变,增大CO2浓度
(1) 0.05mol·L-1·S-1 (2) 25% (3)B C (4)C
试题分析:(1)由表可以看出0~3 s内,二氧化碳的浓度变化减少了
(0.40-0.30)/2=0.05mol,根据CO2(g)+3H2(g)
 CH3OH(g) +H2O(g)可以知道,v(H2)=3v(CO2)=3×0.05/3mol·L-1·S-1=0.05mol·L-1·S-1,(2)平衡时CO2的转化率为:0.10/0.40×100%=25%;(3)对于CO2(g)+3H2(g)
CH3OH(g) +H2O(g)可以知道,v(H2)=3v(CO2)=3×0.05/3mol·L-1·S-1=0.05mol·L-1·S-1,(2)平衡时CO2的转化率为:0.10/0.40×100%=25%;(3)对于CO2(g)+3H2(g) CH3OH(g) +H2O(g)这个反应来说,当容器内压强保持不变和υ逆(CO2)=υ正(CH3OH),则该反应达到平衡,所以本题的答案选择BC,而υ(H2)=3υ(CO2)在整个过程都是如此,故不能用来判断是否达到平衡,而容器内密度保持不变,因为该反应是在2L恒容的密闭容器内250℃条件下,所以整个过程密度不变,故也不可以用来判断是否达到平衡;(4)及时分离出产物,可以提高原料的转化率,但不能增大反应速率,降低温度,反应速率也降低,故AB错误,其他条件不变,增大CO2浓度,可以增大化学反应速率,故C正确,为本题小题的答案。
CH3OH(g) +H2O(g)这个反应来说,当容器内压强保持不变和υ逆(CO2)=υ正(CH3OH),则该反应达到平衡,所以本题的答案选择BC,而υ(H2)=3υ(CO2)在整个过程都是如此,故不能用来判断是否达到平衡,而容器内密度保持不变,因为该反应是在2L恒容的密闭容器内250℃条件下,所以整个过程密度不变,故也不可以用来判断是否达到平衡;(4)及时分离出产物,可以提高原料的转化率,但不能增大反应速率,降低温度,反应速率也降低,故AB错误,其他条件不变,增大CO2浓度,可以增大化学反应速率,故C正确,为本题小题的答案。点评:本题考查了化学反应速率、转化率、化学平衡,这些考点都是高考考查的重点和难点,本题难度不大。

练习册系列答案
相关题目
 FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应 ②Fe(s)+H2O(g) 
 PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表: N2O3(g) ΔH<0
N2O3(g) ΔH<0 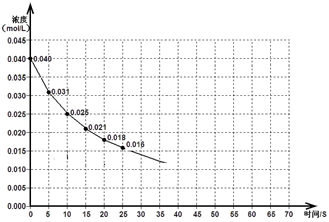

 Ni(CO)4(g)+Q
Ni(CO)4(g)+Q Ni(S)+4CO(g)
Ni(S)+4CO(g)
 C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
C(g) ΔH﹤0,图2-17中表示的生成物C的百分含量(C%)与时间t的关系正确的是( )
 2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )
2SO3(g)是制备硫酸的重要反应。下列叙述正确的是( )