题目内容
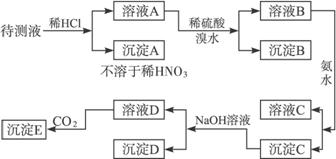
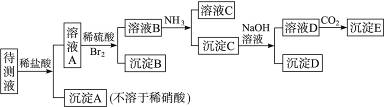
某待测溶液中可能含有Na+、SO42-、SO32-、CO32-、Cl-、NO3-、HCO3-等离子,进行了下述实验.(所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量)
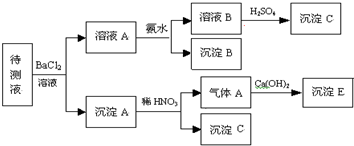
(1)判断待测液中有无SO42-、SO32-,并说明理由:
(2)写出沉淀B的化学式:
(3)沉淀C可能是什么物质:
(4)写出产生沉淀B的离子方程式:

(1)判断待测液中有无SO42-、SO32-,并说明理由:
含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种
含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种
;(2)写出沉淀B的化学式:
BaCO3
BaCO3
;(3)沉淀C可能是什么物质:
BaSO4
BaSO4
;(4)写出产生沉淀B的离子方程式:
HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O
HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O
.分析:待测液和氯化钡反应生成沉淀A,说明待测液中含有SO42-、SO32-、CO32-中的一种、两种或三种,向沉淀中加稀硝酸后,沉淀部分溶解生成气体,说明待测液中含有碳酸根离子,亚硫酸钡能被硝酸氧化生成硫酸钡,所以沉淀C是硫酸钡,所以此实验证明待测液中含有SO42-、SO32-中的一种或两种,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀E;
溶液A中加氨水生成沉淀,氨水和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子反应生成碳酸钡沉淀B,说明待测液中含有碳酸氢根离子,加入的氯化钡是过量的,钡离子和硫酸根离子反应生成硫酸钡沉淀,再根据元素化合物的性质分析解答.
溶液A中加氨水生成沉淀,氨水和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子反应生成碳酸钡沉淀B,说明待测液中含有碳酸氢根离子,加入的氯化钡是过量的,钡离子和硫酸根离子反应生成硫酸钡沉淀,再根据元素化合物的性质分析解答.
解答:解:待测液和氯化钡反应生成沉淀A,说明待测液中含有SO42-、SO32-、CO32-中的一种、两种或三种,向沉淀中加稀硝酸后,沉淀部分溶解生成气体,说明待测液中含有碳酸根离子,亚硫酸钡能被硝酸氧化生成硫酸钡,所以此实验证明待测液中含有SO42-、SO32-中的一种或两种,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀E;
溶液A中加氨水生成沉淀,氨水和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子反应生成碳酸钡沉淀,说明待测液中含有碳酸氢根离子,加入的氯化钡是过量的,钡离子和硫酸根离子反应生成硫酸钡沉淀,再根据元素化合物的性质分析解答.
(1)通过以上分析知,待测液中含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
故答案为:含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
(2)通过以上分析知,沉淀B是BaCO3,故答案为:BaCO3;
(3)通过以上分析知,沉淀C是BaSO4,故答案为:BaSO4;
(4)氨水和碳酸氢根离子、钡离子反应生成碳酸钡沉淀和铵根离子、水,离子方程式为HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O,
故答案为:HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O.
溶液A中加氨水生成沉淀,氨水和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子反应生成碳酸钡沉淀,说明待测液中含有碳酸氢根离子,加入的氯化钡是过量的,钡离子和硫酸根离子反应生成硫酸钡沉淀,再根据元素化合物的性质分析解答.
(1)通过以上分析知,待测液中含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
故答案为:含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
(2)通过以上分析知,沉淀B是BaCO3,故答案为:BaCO3;
(3)通过以上分析知,沉淀C是BaSO4,故答案为:BaSO4;
(4)氨水和碳酸氢根离子、钡离子反应生成碳酸钡沉淀和铵根离子、水,离子方程式为HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O,
故答案为:HCO3-+NH3?H2O+Ba2+=BaCO3↓+NH4++H2O.
点评:本题考查元素化合物的特性和反应,用框图设问可以考查学生正向思维、逆向思维、发散和收敛思维,能根据题眼正确判断化合物是解本题的关键,注意所加BaCl2、H2SO4、HNO3、Ca(OH)2均过量,硝酸能把亚硫酸钡氧化成硫酸钡.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目