题目内容
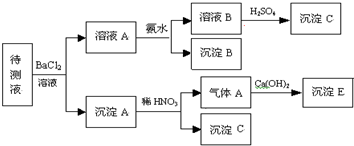
某待测溶液中可能含有SO
、SO
、CO
、HCO
、NO
、Cl-、Br-中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).

请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填).
(2)待测溶液中是否有SO
、SO
:
(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是
2- 4 |
2- 3 |
2- 3 |
- 3 |
- 3 |

请回答下列问题:
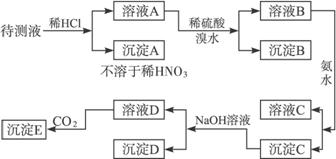
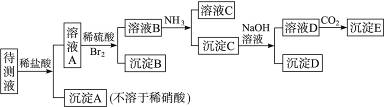
(1)根据上述框图信息填写下表(不能确定的不填).
| 肯定存在的离子 | 肯定没有的离子 | 沉淀D | |
| 化学式或离子符号 | HCO3- HCO3- |
Br- Br- |
BaSO4 BaSO4 |
2- 3 |
2- 4 |
含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种
含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种
.若气体D遇空气变红色,则生成沉淀D时肯定发生的反应的离子方程式为3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O
3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O
,形成沉淀B时反应的离子方程式为HCO3-+Ba2++OH-═BaCO3↓+H2O
HCO3-+Ba2++OH-═BaCO3↓+H2O
.(3)若Mn+为常见金属阳离子且原子序数不大于20,则要确定它具体是何种离子的方法是
做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+
做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+
.分析:由沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4,故溶液中SO42-、SO32-至少有一种;由每次实验所用试剂均足量知溶液A中含有Ba2+,在加入碱后能得到白色沉淀B,则原待测溶液中一定含有HCO3-;溶液B中加入足量的氯水后仍得到无色溶液,说明原待测液中无Br-,不能确定是否有NO3-、CO32-、Cl-;
若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3;
原子序数不大于20的金属阳离子有Li+、Be2+、Na+、Mg2+、Al3+、K+、Ca2+,Al3+与HCO,SO42-、SO32-与Ca2+不能大量共存,故金属阳离子不可能是Al3+或Ca2+,由待测溶液与浓NaOH溶液混合后无明显变化知溶液中没有Mg2+,结合Mn+为常见离子且原子序数不大于20知,Mn+只能是Na+或K+,可通过焰色实验来确定是钾还是钠,
根据以上分析完成即可.
若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3;
原子序数不大于20的金属阳离子有Li+、Be2+、Na+、Mg2+、Al3+、K+、Ca2+,Al3+与HCO,SO42-、SO32-与Ca2+不能大量共存,故金属阳离子不可能是Al3+或Ca2+,由待测溶液与浓NaOH溶液混合后无明显变化知溶液中没有Mg2+,结合Mn+为常见离子且原子序数不大于20知,Mn+只能是Na+或K+,可通过焰色实验来确定是钾还是钠,
根据以上分析完成即可.
解答:解:(1)沉淀A与稀硝酸反应仍得到白色沉淀知白色沉淀D为BaSO4,故溶液中SO42-、SO32-至少有一种;由每次实验所用试剂均足量知溶液A中含有Ba2+,在加入碱后能得到白色沉淀B,则原待测溶液中一定含有HCO3-;溶液B中加入足量的氯水后仍得到无色溶液,说明原待测液中无Br-,不能确定是否有NO3-、CO32-、Cl-,
根据以上分析可知,原待测溶液中一定含有HCO3-;一定没有无Br-;沉淀D为:BaSO4,
故答案为:HCO3-;Br-;BaSO4;
(2)因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3,生成沉淀D的离子方程式为:3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,
沉淀B为碳酸钡,反应的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,
故答案为:含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O;HCO3-+Ba2++OH-═BaCO3↓+H2O;
(3)原子序数不大于20的金属阳离子有Li+、Be2+、Na+、Mg2+、Al3+、K+、Ca2+,Al3+与HCO,SO42-、SO32-与Ca2+不能大量共存,故金属阳离子不可能是Al3+或Ca2+,由待测溶液与浓NaOH溶液混合后无明显变化知溶液中没有Mg2+,结合Mn+为常见离子且原子序数不大于20知Mn+只能是Na+或K+,可通过焰色实验来确定是钾还是钠,方法是:做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是钾;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是钠,
故答案为:做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
根据以上分析可知,原待测溶液中一定含有HCO3-;一定没有无Br-;沉淀D为:BaSO4,
故答案为:HCO3-;Br-;BaSO4;
(2)因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;
若气体D遇空气变红色时,表明D中肯定有NO,沉淀A中肯定有BaSO3,生成沉淀D的离子方程式为:3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O,
沉淀B为碳酸钡,反应的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,
故答案为:含有SO42-、SO32-中的一种或两种,因为待测液加入BaCl2溶液和稀HNO3生成了BaSO4沉淀,BaSO4的生成可能来自SO42-或SO32-中的一种或两种;3BaSO3+2H++2NO3-═2NO↑+3BaSO4↓+H2O;HCO3-+Ba2++OH-═BaCO3↓+H2O;
(3)原子序数不大于20的金属阳离子有Li+、Be2+、Na+、Mg2+、Al3+、K+、Ca2+,Al3+与HCO,SO42-、SO32-与Ca2+不能大量共存,故金属阳离子不可能是Al3+或Ca2+,由待测溶液与浓NaOH溶液混合后无明显变化知溶液中没有Mg2+,结合Mn+为常见离子且原子序数不大于20知Mn+只能是Na+或K+,可通过焰色实验来确定是钾还是钠,方法是:做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是钾;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是钠,
故答案为:做焰色反应实验,若透过蓝色钴玻璃片观察到紫色火焰,说明是K+;若不透过蓝色钴玻璃片观察到黄色火焰,则说明是Na+.
点评:本题考查了常见阴阳离子的检验方法,注意根据实验现象判断离子共存,要掌握根据实验现象判断存在的离子,排除与该离子反应的离子,本题难度中等.

练习册系列答案
相关题目