题目内容
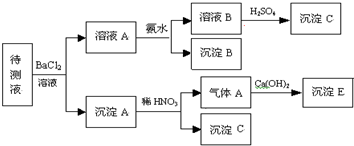
某待测溶液中可能含有Fe2+、Fe3+、Ag+、Al3+、Ba2+、Ca2+、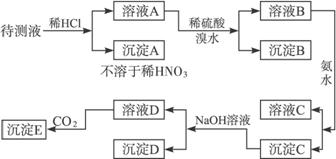
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+,并写出理由。
(2)写出沉淀D的分子式:___________________。
(3)写出从溶液D生成沉淀E的反应的离子方程式:______________________。
(1)含有Ba2+、Ca2+中的一种或两种,因为BaSO4难溶于水,CaSO4微溶于水
(2)Fe(OH)3
(3)2![]() +CO2+3H2O====2Al(OH)3↓+
+CO2+3H2O====2Al(OH)3↓+![]() 或
或![]() +CO2+2H2O====Al(OH)3↓+
+CO2+2H2O====Al(OH)3↓+![]()
解析:由溶液A+稀硫酸![]() 溶液B+沉淀B,知待测液中有Ba2+、Ca2+中的一种或两种,由溶液B+氨水
溶液B+沉淀B,知待测液中有Ba2+、Ca2+中的一种或两种,由溶液B+氨水![]() 沉淀C+溶液C,知待测液中含有Fe2+、Fe3+、Al3+中一种或多种,再由沉淀C+NaOH溶液
沉淀C+溶液C,知待测液中含有Fe2+、Fe3+、Al3+中一种或多种,再由沉淀C+NaOH溶液![]() 沉淀D+溶液D,推知沉淀D是Fe(OH)3,溶液D是NaAlO2溶液。
沉淀D+溶液D,推知沉淀D是Fe(OH)3,溶液D是NaAlO2溶液。

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目