题目内容
【题目】海洋是一个巨大的化学资源宝库.海水综合利用的部分流程如下: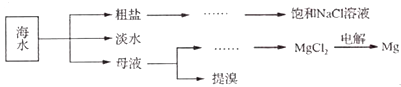
已知:Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
(1)电解饱和NaCl溶液的离子方程式为 , 粗盐中常含Ca2+、Mg2+、SO42﹣等杂质离子,可依次加入NaOH溶液、、、稀盐酸来进行提纯.
(2)下列方法可用于海水淡化的是(填字母)
A.蒸馏法
B.萃取法
C.过滤法
(3)工业上用电解法制Mg时,通常在MgCl3中加入CaCl2 , 其原因是:①增加电解质的密度,便于分离出熔融的镁:②
(4)用母液(含Na+、K+、Mg2+、C1﹣、Br﹣等离子)提取溴,其生产流程如下: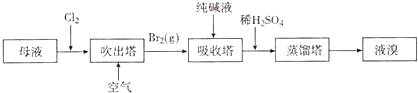
①若吸收塔中的溶液含BrO3﹣ , 则吸收塔中反应的离子方程式为 .
②母液中通入Cl2已获得含溴的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液 .
③向蒸馏塔中通人水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
【答案】
(1)2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3
H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3
(2)A
(3)使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗
(4)3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;富集溴,提高Br2的浓度;温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来
【解析】解:(1)惰性电极电解NaCl溶液,阳极上是氯离子失电子,2Cl﹣﹣2e﹣=Cl2↑,阴极上是氢离子得电子,2H++2e﹣=H2↑,由两极上的电极反应可以得到总反应为2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣ , 钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
H2↑+Cl2↑+2OH﹣ , 钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,则试剂可依次加入NaOH、BaCl2、Na2CO3、HCl,
所以答案是:2Cl﹣+2H2O ![]() H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3;
H2↑+Cl2↑+2OH﹣;BaCl2;Na2CO3;
(2.)A.蒸馏法,是把水从水的混合物中分离出来,得到纯净的水,故A正确;
B.萃取法,对于微溶于水的有机物,可用萃取法,水中没有微溶于水的有机物,故B错误;
C.过滤是分离固体和溶液的操作,不能淡化水,故C错误
所以答案是:A;
(3.)离子浓度越大其熔融盐的导电性越强,在MgCl2中加入CaCl2 , 进行电解,增大离子浓度,从而增大熔融盐的导电性,使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗,
所以答案是:使氯化镁熔融温度降低,从而减少冶炼过程中的能量消耗;
(4.)由流程可知,①中发生2Br﹣+Cl2=2Cl﹣+Br2 , 利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔中的溶液含BrO3﹣ , 可知发生3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,③中发生5Br﹣+BrO3﹣+6H+=3Br2+3H2O,最后利用蒸馏得到溴,
①纯碱是碳酸钠,与溴反应有BrO3﹣生成,反应的离子方程式为3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑,
所以答案是:3CO32﹣+3Br2=5Br﹣+BrO3﹣+3CO2↑;
②从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
所以答案是:富集溴,提高Br2的浓度;
③温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,
所以答案是:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.

【题目】下列选项中的物质与其特征反应对应正确的是
选项 | 物质 | 特征反应 |
A | 油脂 | 遇浓硝酸变黄 |
B | 蛋白质 | 碱性条件下发生水解反应 |
C | 淀粉 | 常温下,遇碘化钾溶液变蓝 |
D | 葡萄糖 | 加热条件下,与新制Cu(OH)2反应生成砖红色沉淀 |
A.AB.BC.CD.D