题目内容
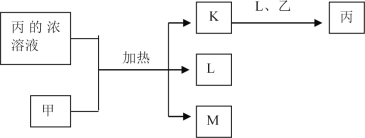
【题目】处理烟气中的SO2可以采用碱吸——电解法,其流程如左图;模拟过程Ⅱ如右图,下列推断正确的是


A. 膜1为阴离子交换膜,膜2为阳离子交换膜
B. 若用锌锰碱性电池为电源,a极与锌极相连
C. a极的电极反应式为2H2O一4e一=4H++O2↑
D. 若收集22.4L的P(标准状况下),则转移4mol电子
【答案】B
【解析】
由流程图可知,氢氧化钠溶液与烟气中的SO2反应生成亚硫酸钠溶液,电解亚硫酸钠溶液制得氢氧化钠溶液和硫酸,制得的氢氧化钠溶液可以循环使用;电解Na2SO3溶液时,亚硫酸根通过阴离子交换膜进入右室,在b极上失电子发生氧化反应生成硫酸根,SO32——2e—+H2O= SO42—+,2H+,则b极为阳极,与电源正极相连,左室中,水在a极得电子发生还原反应生成氢气,电极反应式为2H2O+2e一=2OH—+H2↑,溶液中OH—浓度增大,Na+离子通过阳离子交换膜进入左室,则a极为阴极,与电源负极相连。
A项、电解Na2SO3溶液时,亚硫酸根通过阴离子交换膜进入右室,Na+离子通过阳离子交换膜进入左室,则膜1为阳离子交换膜,膜2为阴离子交换膜,故A错误;
B项、a极为阴极,与锌锰碱性电池的负极锌极相连,故B正确;
C项、a极为阴极,水在阴极得电子发生还原反应生成氢气,电极反应式为2H2O+2e一=2OH—+H2↑,故C错误;
D项、由阴极电极反应式可知,若收集标准状况下22.4L H2,转移2mol电子,故D错误。
故选B。

 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案【题目】工业上常利用CO2为初始反应物,合成一系列重要的化工原料。
(1)以CO2和NH3为原料合成尿素是利用CO2的成功范例。在尿素合成塔中的主要反应可表示如下:
反应Ⅰ:2NH3(g)+CO2(g)![]() NH2COONH4(s) △H1
NH2COONH4(s) △H1
反应Ⅱ:NH2COONH4(s)![]() CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
CO(NH2)2(s)+H2O(g) △H2=+72.49kJ/mol
总反应:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
CO(NH2)2(s)+H2O(g) △H3=-86.98kJ/mol 请回答下列问题:
①根据8电子稳定构型,写出 CO(NH2)2的结构式_________________。
②反应Ⅰ的△H1=______________。
③在____(填“高温”或“低温”)情况下有利于反应Ⅱ的自发进行。
④一定温度下,在体积固定的密闭容器中按 n(NH3):n(CO2)=2:1 进行反应Ⅰ,下列能说明反应Ⅰ达到了平衡状态的是_______(填序号)。
A.混合气体的平均相对分子质量不再变化
B.容器内气体总压强不再变化
C.NH3与CO2的转化率相等
D.容器内混合气体的密度不再变化
(2)将CO2和H2按质量比25:3充入一定体积的密闭容器中,在不同温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。
CH3OH(g)+H2O(g)。测得CH3OH的物质的量随时间的变化如下图。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为K(Ⅰ)_____K(Ⅱ)(填“ >”“<”或“=”)。
②欲提高CH3OH的平衡产率,可采取的措施除改变温度外,还有__________________(任写两种)。
③一定温度下,在容积均为2L的两个恒容密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容器 | 甲 | 乙 |
反应物起始投入量 | 1molCO2、3molH2 | a molCO2、bmolH2、cmolCH3OH(g) |
c mol H2O(g) (a、b、c 均不为零) | ||
若甲容器平衡后气体的压强为开始的 5/6,则该温度下,反应的平衡常数为__________,要使平衡后乙容器与甲容器中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,乙容器中 c 的取值范围为_______。
【题目】在梨、香蕉等水果中存在着乙酸正丁酯。实验室制备乙酸正丁酯的反应、装置示意图和有关数据如下:
![]()

水中溶解性 | 密度(g·cm-3) | 沸点 | 相对分子质量 | |
乙酸 | 溶于水 | 1.049 2 | 118 | 60 |
正丁醇 | 微溶于水 | 0.809 8 | 117.7 | 74 |
乙酸正丁酯 | 微溶于水 | 0.882 4 | 126.5 | 116 |
实验步骤:
Ⅰ.乙酸正丁酯的制备
在A中加入7.4 g正丁醇、6.0 g乙酸,再加入数滴浓硫酸,摇匀,放入1~2颗沸石。按图安装带分水器的回流反应装置,并在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热A。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中。反应达到终点后,停止加热,记录分出水的体积。
Ⅱ.产品的精制
把分水器中的酯层和A中反应液倒入分液漏斗中,分别用少量水、饱和碳酸钠溶液和水洗涤,分出的产物加入少量无水硫酸镁固体,静置后过滤,将产物常压蒸馏,收集124-126 ℃的馏分,得到5.8 g产品。请回答下列问题:
(1)冷水应从冷凝管的________(填“a”或“b”)口通入。
(2)产品的精制过程中,第一次水洗的目的是________________,第二次水洗的目的是________________,洗涤完成后将有机层从分液漏斗的________(填“上口”或“下口”)转移到锥形瓶中。
(3)本实验提高产品产率的方法是_________________________________________。
(4)判断反应终点的依据是_______________________________________________。
(5)该实验过程中,生成乙酸正丁酯的产率是_______________________________。