题目内容
阿伏加德罗常数约为6.02×1023mol-1,下列叙述中正确的是
⑴.0.25molNa2O2中含有的阴离子数为0.5×6.02×1023 ⑵.7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 ⑶.2.24LCH4中含有的原子数为0.5×6.02×1023
⑷.250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023 ⑸.1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子 ⑹.18g D2O(重水)完全电解,转移
6.02×1023个电子 ⑺.22.4L SO2气体,所含氧原子数为2×6.02×1023
⑻.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
⑴.0.25molNa2O2中含有的阴离子数为0.5×6.02×1023 ⑵.7.5gSiO2晶体中含有的硅氧键数为0.5×6.02×1023 ⑶.2.24LCH4中含有的原子数为0.5×6.02×1023
⑷.250mL2mol/L的氨水中含有NH3·H2O的分子数为0.5×6.02×1023 ⑸.1L 1mol·L―1的HAc溶液中含有6.02×1023个氢离子 ⑹.18g D2O(重水)完全电解,转移
6.02×1023个电子 ⑺.22.4L SO2气体,所含氧原子数为2×6.02×1023
⑻.14g乙烯和丙烯的混合物中,含有共用电子对数目为3×6.02×1023
| A.2个 | B.3个 | C.5个 | D.6个 |
A

⑴错,因为0.25molNa2O2中含有的阴离子0.25moL;⑵正确,n(SiO2)="7.5/60" mol=0.125mol,每摩尔SiO2含有共价键是(1×4+2×2)/2 moL=4mol, 7.5gSiO2晶体中含有的硅氧键数为0.125×4×6.02×1023=0.5×6.02×1023 ;⑶错,不知道气体的存在的条件,无法计算;⑷错,因为氨水中存在这如下平衡NH3 + H2O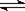 NH3·H2O
NH3·H2O 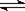 NH4++OH- ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
NH4++OH- ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
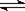 NH3·H2O
NH3·H2O 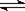 NH4++OH- ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
NH4++OH- ;⑸错,因为Hac是弱电解质。⑹错,18g D2O的物质的量小于1mol,⑺错,因为不知道气体的存在条件;⑻正确,因为乙烯与丙烯的最简式都是CH2,1.4g乙烯与丙烯的混合物中相当于含有0.1molCH2。
练习册系列答案
相关题目
 ,它们的物质的量必相等
,它们的物质的量必相等