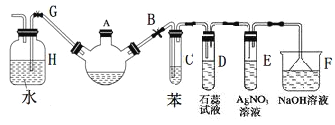
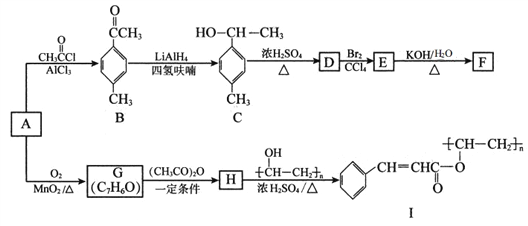
题目内容
【题目】氢化钙(CaH2)固体是一种储氢材料,是登山运动员常用的能源提供剂。
I 、金属Ca 的部分性质有:
① 常温或加热条件下Ca都能与氧气反应;
② Ca常温遇水立即发生剧烈反应生成氢氧化钙和氢气,并放出大量的热;
③ Ca + H2=CaH2(固体)。
II 、固体CaH2的部分性质有:
① 常温:CaH2+ 2H2O = Ca(OH)2+2H2;②CaH2要密封保存。
(l)写出Ca常温遇水立即发生反应的化学方程式:_________;其中氧化剂为_________(填化学式)。
(2)用双线桥法标明反应CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目________________。
(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,如果不考虑中间的损失,理论上两份产生的氢气的物质的量比为________。
【答案】 Ca + 2H2O=Ca(OH)2 + H2↑ H2O 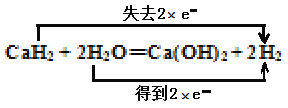 1:2
1:2
【解析】(1)Ca常温遇水发生反应生成氢氧化钙和氢气,化学方程式:Ca + 2H2O=Ca(OH)2 + H2↑;反应物水中氢元素由+1价降为0价,作氧化剂;(2)该反应中H元素化合价由+1价变为0价、H元素化合价由-1价变为0价,其得失电子最小公倍数是2,其电子转移的方向和数目为用双线桥法标明反应:CaH2+ 2H2O = Ca(OH)2+2H2中电子转移的方向和数目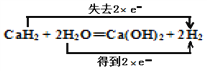 ;(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,1molCa与得到1molH2,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,1molCaH2得到2molH2,不考虑中间的损失,理论上两份产生的氢气的物质的量比为1:2。
;(3)取一定质量的钙,平均分成两等份,一份直接与水反应生成氢气,1molCa与得到1molH2,另一份先生成氢化钙,然后氢化钙与水反应生成氢气,1molCaH2得到2molH2,不考虑中间的损失,理论上两份产生的氢气的物质的量比为1:2。