题目内容
取100mL 0.3mol?L-1和300mL 0.25mol?L-1的硫酸注入500mL的容量瓶中,加水稀释至刻度线,该混合溶液中H+的物质的量浓度是( )
| A.0.21 mol?L-1 | B.0.56 mol?L-1 |
| C.0.42 mol?L-1 | D.0.26 mol?L-1 |
令混合后溶质硫酸的物质的量浓度为a,则:
100mL×0.3mol?L-1+300mL×0.25mol?L-1=500mL×a
解得:a=0.21mol/L,
混合稀释后溶液中c(H+)=2n(H2SO4)=2×0.21mol/L=0.42mol/L,
故选C.
100mL×0.3mol?L-1+300mL×0.25mol?L-1=500mL×a
解得:a=0.21mol/L,
混合稀释后溶液中c(H+)=2n(H2SO4)=2×0.21mol/L=0.42mol/L,
故选C.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
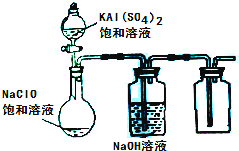 (2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.
(2013?达州模拟)NaClO和KAl(SO4)2都是重要的化工产品,均可应用于造纸业.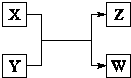 X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.
X、Y、Z、W四种物质有如右相互转化关系,X、W是同主族非金属元素组成的单质;W通常状况下是深红棕色液体;Y、Z是化合物的溶液;Y溶液呈淡绿色.