��Ŀ����
����Ŀ���ֳּ��������绯ѧ�����������ڲⶨO2����.��ͼΪij�����绯ѧ��������ԭ��ʾ��ͼ����֪�ڲⶨO2���������У��������Һ���������ֲ��䡣һ��ʱ���ڣ���ͨ���������Ĵ�������Ϊa L����״������ij�缫������bg������˵����ȷ����
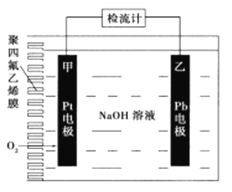
A. Pt�Ϸ���������Ӧ B. Pb�ϵĵ缫��ӦʽΪ4OH--4e-=O2��+2H2O
C. ��Ӧ������ת��OH-�����ʵ���Ϊ0.25bmol D. �����������������������Ϊ0.7b/a
���𰸡�D
������������װ��ͼ������֪���ó�Ϊԭ��أ�ͨ��������һ��Ϊ�������ҵ缫��Pb�缫Ϊ������A��Pt�缫ͨ������Ϊ������������ԭ��Ӧ��A����B��Pb�缫Ϊ������ʧȥ���ӷ���������Ӧ���缫����ʽΪ2Pb+4OH--4e-��2PbO+2H2O��B����C��Pb�缫Ϊ������ʧȥ���ӷ���������Ӧ���缫����ʽΪ2Pb+4OH--4e-��2PbO+2H2O�����4mol���������ӣ��缫��������32g���õ缫���ص�����Ϊbg����ת��OH-�����ʵ���Ϊ0.125bmol��C����D������C�ķ�����֪��ת�Ƶ������ʵ���Ϊ0.125bmol���ɵ缫����ʽΪO2+2H2O+4e-��4OH-���������������Ϊ22.4��0.125b/4L=0.7bL�����������������Ϊ0.7b/a��D��ȷ����ѡD��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�������л��������������ǣ� ��
A. 1��2��4�����ױ�
1��2��4�����ױ�
B.![]() 3������1����ϩ
3������1����ϩ
C.![]() 2������1������
2������1������
D.![]() 1��3���������
1��3���������
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ѡ�� | ʵ�� | ���� | ���� |
A | ��������ͭ�۵�Cu(NO3)2 ��Һ�е���ϡ���� | ͭ�����ܽ� | ϡ��������ͭ���ʷ�Ӧ |
B | ��H2O2��Һ�е����������Ը��������Һ | ���̲����������� | KMnO4��H2O2�ֽ�Ĵ��� |
C | ��ʢ��Ũ��ˮ����ƿ��ͨ���������������ȵIJ�˿����Һ���Ϸ� | ��˿���ֺ��ȣ���ƿ���а��̲��� | ���Ĵ�������ӦΪ���ȷ�Ӧ |
D | �������Ʒ���ȼ�ճ��У���ȼ�� Ѹ�����뼯��SO2�ļ���ƿ | ����������ɫ���̣���ƿ ���а�ɫ�������� | SO2���л�ԭ�� |
A. A B. B C. C D. D
