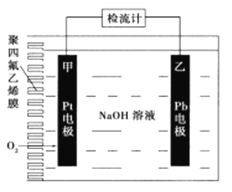
��Ŀ����
����Ŀ����֪ 25��C��101 kPa ʱ��2SO2(g)��O2(g) ![]() 2SO3(g)����H����197 kJ��mol-1�����ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ���ų�����ΪQ1������һ�������ͬ��������ͨ��1 mol SO2��0.5 mol O2 �ﵽƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����
2SO3(g)����H����197 kJ��mol-1�����ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ���ų�����ΪQ1������һ�������ͬ��������ͨ��1 mol SO2��0.5 mol O2 �ﵽƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����
A. 2Q2<Q1<197 kJ B. Q2��Q1��197 kJ C. Q1<Q2<197 kJ D. 2Q2��Q1<197 kJ
���𰸡�A
����������Ӧ���Ȼ�ѧ����ʽΪ��2SO2(g)��O2(g)![]() 2SO3(g) ��H=-197kJ/mol�����Ȼ�ѧ����ʽ��֪�������������·�Ӧ����2molSO3�������197kJ������2mol SO2��1molO2�������ǿ��淴Ӧ���������ɵ�����������С��2mol������Q1��197kJ��ͨ��1molSO2��0.5mol O2�����ת���������2mol SO2��1molO2��ͬ�������Ϊ0.5Q1kJ�����Ǵ�ʱ��ϵѹǿ�ȼ���2mol SO2��1molO2ҪС������ƽ��������ƶ���ʵ�ʷų���������0.5Q1�����ϵã�2Q2��Q1��197 kJ����ѡA��
2SO3(g) ��H=-197kJ/mol�����Ȼ�ѧ����ʽ��֪�������������·�Ӧ����2molSO3�������197kJ������2mol SO2��1molO2�������ǿ��淴Ӧ���������ɵ�����������С��2mol������Q1��197kJ��ͨ��1molSO2��0.5mol O2�����ת���������2mol SO2��1molO2��ͬ�������Ϊ0.5Q1kJ�����Ǵ�ʱ��ϵѹǿ�ȼ���2mol SO2��1molO2ҪС������ƽ��������ƶ���ʵ�ʷų���������0.5Q1�����ϵã�2Q2��Q1��197 kJ����ѡA��

��ϰ��ϵ�д�
 �п�������㾫��ϵ�д�
�п�������㾫��ϵ�д� ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
�����Ŀ