题目内容
(2013?江西二模)(化学-选修物质结构与性质)
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2 np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于
(2)当n=3时,A与B形成的晶体属于
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是
(4)已知某红紫色配合物的组成为CoCl3?5NH3?H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为
(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
A、B、C、D为前四周期元素.A元素的原子价电子排布为ns2 np2,B元素原子的最外层电子数是其电子层数的3倍,C元素原子的M能层的p能级有3个未成对电子,D元素原子核外的M能层中只有2对成对电子.请回答下列问题:
(1)当n=2时,AB2属于
非极性
非极性
分子(填“极性”或“非极性”),分子中有2
2
个δ键、2
2
个π键. A6H6分子中A原子的杂化轨道类型是sp2
sp2
杂化.(2)当n=3时,A与B形成的晶体属于
原子
原子
晶体.(3)若A元素的原子价电子排布为3s23p2,A、C、D三种原子的电负性由大到小的顺序是
S>P>Si
S>P>Si
(用元素符号表示);A、C、D三种元素的第一电离能由大到小的顺序是P>S>Si
P>S>Si
(用元素符号表示).(4)已知某红紫色配合物的组成为CoCl3?5NH3?H2O,该配合物中的中心离子钴离子在基态时的核外电子排布式为
1s22s22p63s23p63d6或[Ar]3d6
1s22s22p63s23p63d6或[Ar]3d6
,作为配位体之一的NH3分子的空间构型为三角锥形(或四面体形)
三角锥形(或四面体形)
.(5)金属铁的晶体在不同温度下有两种堆积方式,晶胞分别如图所示,体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为
1:2
1:2
.
分析:B元素原子的最外层电子数是其电子层数的3倍,应为O元素,C元素原子的M能层的p能级有3个未成对电子,核外电子排布式为1S22S22P63S23P3,为P元素,D元素原子核外的M能层中只有2对成对电子,核外电子排布式为1S22S22P63S23P4,为S元素.
(1)当n=2时,A元素的原子价电子排布为2s22p2,A为C元素,B元素原子的最外层电子数是其电子层数的3倍,应为O元素,二者形成的化合物为CO2,以此解题该题;
(2)当n=3时,A元素的原子价电子排布为3s23p2,A为Si元素,二者形成的化合物为SiO2,为原子晶体;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素分别为Si、P、S元素,根据原子半径的递变规律判断原子半径大小,根据电负性的递变规律判断电负性的大小顺序;
(4)根据钴的电子排布式判断离子的电子排布式,钴的电子排布式为1s22s22p63s23p63d74s2,CoCl3?5NH3?H2O中的中心离子钴离子的带3个正电荷,以此来书写离子的电子排布式;NH3价层电子对为4,有一个孤电子对,结构为三角锥形;
(5)利用均摊法计算晶胞的结构.
(1)当n=2时,A元素的原子价电子排布为2s22p2,A为C元素,B元素原子的最外层电子数是其电子层数的3倍,应为O元素,二者形成的化合物为CO2,以此解题该题;
(2)当n=3时,A元素的原子价电子排布为3s23p2,A为Si元素,二者形成的化合物为SiO2,为原子晶体;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素分别为Si、P、S元素,根据原子半径的递变规律判断原子半径大小,根据电负性的递变规律判断电负性的大小顺序;
(4)根据钴的电子排布式判断离子的电子排布式,钴的电子排布式为1s22s22p63s23p63d74s2,CoCl3?5NH3?H2O中的中心离子钴离子的带3个正电荷,以此来书写离子的电子排布式;NH3价层电子对为4,有一个孤电子对,结构为三角锥形;
(5)利用均摊法计算晶胞的结构.
解答:解:B元素原子的最外层电子数是其电子层数的3倍,应为O元素,C元素原子的M能层的p能级有3个未成对电子,核外电子排布式为1S22S22P63S23P3,为P元素,D元素原子核外的M能层中只有2对成对电子,核外电子排布式为1S22S22P63S23P4,为S元素.
(1)当n=2时,A元素的原子价电子排布为2s22p2,A为C元素,B元素原子的最外层电子数是其电子层数的3倍,应为O元素,二者形成的化合物为CO2,结构式为O=C=O,为非极性分子,分子中含有2个δ键,2个π键,C6H6分子中每个C原子形成3个δ键,1个大π键,为sp2杂化,故答案为:非极性;2;2;sp2;
(2)当n=3时,A元素的原子价电子排布为3s23p2,A为Si元素,二者形成的化合物为SiO2,为原子晶体,故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素分别为Si、P、S元素,根据同周期元素从左到右原子序数越大半径越大,则有S>P>Si;同周期元素从左到右第一电离能呈逐渐增大的趋势,但P价层电子为半充满状态,较稳定,电离能大于S,故顺序为 P>S>Si,故答案为:S>P>Si; P>S>Si;
(4)钴的电子排布式为1s22s22p63s23p63d74s2,CoCl3?5NH3?H2O中的中心离子钴离子的带3个正电荷,离子的电子排布式为1s22s22p63s23p63d6或[Ar]3d6,NH3价层电子对为4,有一个孤电子对,结构为三角锥形,故答案为:1s22s22p63s23p63d6或[Ar]3d6;三角锥形(或四面体形);
(5)体心立方晶胞中含有Fe原子的个数为:8×
+1=2,面心立方晶胞中实际含有的Fe原子个数为:8×
+6×
=4,所以体心立方晶胞和面心立方晶胞中实际含有的Fe原子个数之比为1:2,故答案为:1:2.
(1)当n=2时,A元素的原子价电子排布为2s22p2,A为C元素,B元素原子的最外层电子数是其电子层数的3倍,应为O元素,二者形成的化合物为CO2,结构式为O=C=O,为非极性分子,分子中含有2个δ键,2个π键,C6H6分子中每个C原子形成3个δ键,1个大π键,为sp2杂化,故答案为:非极性;2;2;sp2;
(2)当n=3时,A元素的原子价电子排布为3s23p2,A为Si元素,二者形成的化合物为SiO2,为原子晶体,故答案为:原子;
(3)若A元素的原子价电子排布为3s23p2,A、C、D三种元素分别为Si、P、S元素,根据同周期元素从左到右原子序数越大半径越大,则有S>P>Si;同周期元素从左到右第一电离能呈逐渐增大的趋势,但P价层电子为半充满状态,较稳定,电离能大于S,故顺序为 P>S>Si,故答案为:S>P>Si; P>S>Si;
(4)钴的电子排布式为1s22s22p63s23p63d74s2,CoCl3?5NH3?H2O中的中心离子钴离子的带3个正电荷,离子的电子排布式为1s22s22p63s23p63d6或[Ar]3d6,NH3价层电子对为4,有一个孤电子对,结构为三角锥形,故答案为:1s22s22p63s23p63d6或[Ar]3d6;三角锥形(或四面体形);
(5)体心立方晶胞中含有Fe原子的个数为:8×
| 1 |
| 8 |
| 1 |
| 8 |
| 1 |
| 2 |
点评:本题考查元素推断题,题目较为综合,涉及分子的杂化、晶体的类型、电子排布式的书写以及晶胞的计算等知识,本题推断元素的种类是正确解答的关键.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
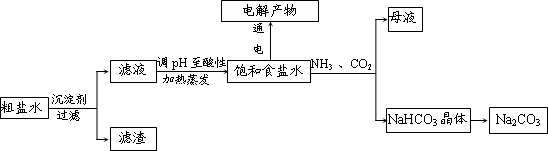
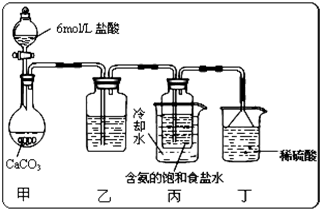
 (2013?江西二模)某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )
(2013?江西二模)某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份.向其中一份中逐渐加入铜粉,最多能溶解9.6g.向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示(已知硝酸只被还原为NO气体).下列分析或结果错误的是( )