题目内容
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.10 g 46%的乙醇水溶液中所含氢原子数目为1.2NA
B.标准状况下,2.24 L氯气溶于水发生反应,转移的电子数目为0.1NA
C.高温下,0.2 mol的铁与足量的水蒸气反应,生成氢气的分子数目为0.3NA
D.25℃时,100 mL pH=13的Ba(OH)2溶液中OH﹣的数目为0.02NA
【答案】A
【解析】解:A.12.10 g 46%的乙醇水溶液中含有C2H5OH 0.1 mol、H2O 0.3 mol,二者含有的氢原子数目的总和是1.2NA , 故A正确; B.氯气溶于水时只有少量Cl2与水发生反应Cl2+H2OHCl+HClO,所以2.24 L氯气转移的电子数目小于0.1NA , 故B错误;
C.高温下,铁与水蒸气发生下列反应:3Fe+4H2O(g) ![]() Fe3O4+4H2 , 0.2 mol铁参加反应生成氢气的分子数目应为
Fe3O4+4H2 , 0.2 mol铁参加反应生成氢气的分子数目应为 ![]() NA , 故C错误;
NA , 故C错误;
D.100 mL pH=13的Ba(OH)2溶液中OH﹣的浓度是0.1 molL﹣1 , 其中含有的OH﹣数目为0.01NA , 故D错误;
故选:A.

 百年学典课时学练测系列答案
百年学典课时学练测系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
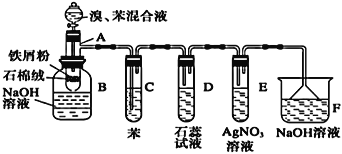
(A为具有支管的试管,在其下端开了一个小孔。塞好石棉绒。再加入少量铁屑粉)
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水溶性 | 微溶 | 微溶 | 微溶 |
填写下列空白:
(1)向反应容器A中逐滴加入溴和苯的混合液,几秒钟内就发生反应。写出A中有机物发生的反应方程式(有机物写结构简式):______________________,反应类型为______________。
(2)反应开始后,可观察到D中溶液变红,E中出现__________________,试管C中苯的作用是__________。用相关化学用语解释D中溶液变红的原因________________。
(3)反应2~3min后,在B中可观察到在溶液中出现红色絮状沉淀、底部有油状液体。生成红色絮状沉淀的离子方程式为_______________________________。
(4)向B中分离出的油状液体加入少量无水氯化钙,静置、过滤。加入氯化钙的目的是________________。
(5)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,下列操作中必需的是______(填入正确选项前的字母)。
A.蒸发 B.过滤 C.蒸馏 D.萃取
(6)在A~F中,具有防倒吸作用的有_________(填字母)。
【题目】用如图装置制取、提纯并收集下表中的四种气体(a、b、c、d表示相应仪器中加入的试剂,收集装置略去).其中可行的是( )
气体 | a | b | c | d | |
A | CO2 | 稀硫酸 | 石灰石 | 饱和Na2CO3溶液 | 浓H2SO4 |
B | Cl2 | 浓盐酸 | KMnO4固体 | 饱和NaCl溶液 | 浓H2SO4 |
C | NH3 | 饱和NH4Cl溶液 | 消石灰 | H2O | 碱石灰 |
D | H2 | 硝酸 | 锌粒 | H2O | P2O5 |

A.A
B.B
C.C
D.D

