题目内容
(1)在恒温恒容的密闭容器中,充入物质的量之比为1:4的N2 和H2,一定时间后达到平衡时,测得N2和H2的物质的量之比为1:5.计算平衡混合气体中NH3的体积分数及N2的转化率.
(2)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%.若仍在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x molH2和y molN2,反应达平衡时有3a molNH3生成,N2的转化率仍为b%.则x=
(2)在恒温、恒压和使用催化剂的条件下,已知:在容积可变的密闭容器中,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%.若仍在恒温、恒压和使用催化剂的条件下,在体积可变的密闭容器中充入x molH2和y molN2,反应达平衡时有3a molNH3生成,N2的转化率仍为b%.则x=
9
9
,y=3
3
.分析:(1)设出氮气、氢气的物质的量n、4n及氨气的转化率x,根据达到平衡时N2和H2的物质的量之比为1:5,计算出混合气体中NH3的体积分数及N2的转化率;
(2)压强不变,气体的物质的量不影响平衡,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%;若平衡时有3a molNH3生成,N2的转化率仍为b%,则充入氮气3mol,氢气是氮气的3倍,即9mol.
(2)压强不变,气体的物质的量不影响平衡,充入含3molH2和1molN2混合气体,反应达平衡时有a molNH3生成,N2的转化率为b%;若平衡时有3a molNH3生成,N2的转化率仍为b%,则充入氮气3mol,氢气是氮气的3倍,即9mol.
解答:解:(1)设氮气、氢气的物质的量为n、4n,达到平衡时氮气的质量为x,
N2 (g)+3H2(g)?2NH3(g)
1 3
n?x 3nx
根据N2和H2的物质的量之比为1:5,列式为:(n-nx):(4n-3nx)=1:5,
解得:x=50%,
反应消耗了0.5nmol氮气,则生成了2×0.5nmol=nmol,
氨气的体积分数为:
×100%=25%,
答:氨气的体积分数为25%,氮气的转化率为50%;
(2)在恒温恒压条件下,1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,
故答案为:9;3.
N2 (g)+3H2(g)?2NH3(g)
1 3
n?x 3nx
根据N2和H2的物质的量之比为1:5,列式为:(n-nx):(4n-3nx)=1:5,
解得:x=50%,
反应消耗了0.5nmol氮气,则生成了2×0.5nmol=nmol,
氨气的体积分数为:
| n |
| n-0.5n+4n-3×0.5n+n |
答:氨气的体积分数为25%,氮气的转化率为50%;
(2)在恒温恒压条件下,1molN2与3molH2的混合气体通入一个容积可变的容器中发生反应,达平衡后,生成a molNH3,
则只通入N2与H2,达平衡时生成3amolNH3,则开始时应通入N23mol,且平衡时NH3 的质量分数与前者相同,
及极限转化后起始的量与原起始量成正比,故H2的物质的量为3mol×3=9mol,
故答案为:9;3.
点评:本题较难,考查化学平衡中等效平衡的计算,明确温度与压强不变时,起始反应物的量成正比则平衡等效是解答本题的关键.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
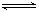 2
SO3 (g) △H<O,达到平衡后,生成了a
mol SO3。[来源:学_科_网]
2
SO3 (g) △H<O,达到平衡后,生成了a
mol SO3。[来源:学_科_网] 2 NH3 (每生成2 mol
NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是
2 NH3 (每生成2 mol
NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,则下列关系正确的是 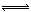 2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,下列关系正确的是
2 NH3 (每生成2 mol NH3放出92.4 kJ的热量),在恒温恒压的密闭容器中进行如下实验:①通入1 mol N2和3 mol H2,达平衡时放出热量为Q1,②通入2 mol N2和6 mol H2,达平衡时放出热量为Q2,下列关系正确的是