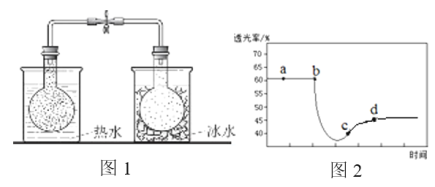
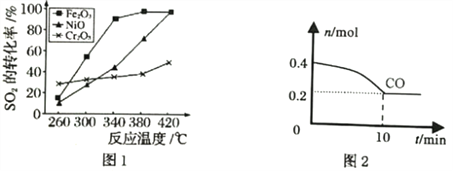
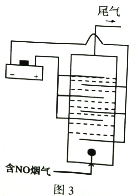
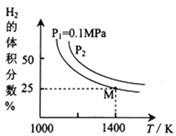
题目内容
【题目】太阳能光电池具有可靠稳定、寿命长、安装维护简便等优点,现已得到广泛应用。氮化镓(GaN)光电池的结构如图所示。下列说法中正确的是( )

A. 该装置系统中只存在光能与电能之间的转化
B. Cu电极:CO2+8H+-8e-=CH4+2H2O
C. 工作时,产生的O2、CH4体积比为1∶1(同温同压)
D. 离子交换膜为质子交换膜,H+从左池移向右池
【答案】D
【解析】
由氮化镓(GaN)光电池的工作原理装置图可知,左池GaN为负极水失电子发生氧化反应生成氧气,右池Cu电极为正极发生还原反应,CO2得到电子被还原生成CH4,电极反应式为CO2+8e-+8H+═CH4+2H2O。A.由氮化镓(GaN)光电池的工作原理装置图可知,该装置系统中存在太阳能转变为化学能,化学能转变为电能,电能又转变为热能、光能等,故A错误;B.右池Cu电极为正极发生还原反应,CO2得到电子被还原生成CH4,电极反应式为CO2+8e-+8H+═CH4+2H2O,故B错误;C.根据转移电子守恒可知,同温同压产生的O2、CH4体积比为2:1,故C错误;D.阳离子向正极移动,所以离子交换膜为质子交换膜,H+从负极左池移向正极右池,故D正确;故选D。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目