题目内容
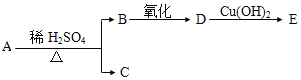
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色),分别进行如下两个实验:
N2O4(无色),分别进行如下两个实验:
实验ⅰ:将NO2球分别浸泡在热水和冰水中,现象如图1。
实验ⅱ:将一定量的NO2充入注射器中后封口,测定改变注射器体积的过程中气体透光率随时间的变化(气体颜色越深,透光率越小),如图2。下列说法不正确的是
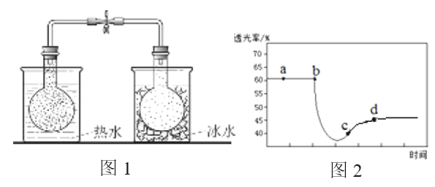
A. 图1现象说明该反应为放热反应
B. 图2中b点的操作是压缩注射器
C. c点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(d)<T(c)
【答案】D
【解析】
图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,压强增大平衡虽正向移动,但二氧化氮浓度增大,混合气体颜色变深,压强减小平衡逆向移动,但二氧化氮浓度减小,混合气体颜色变浅,据图分析,b点开始是压缩注射器的过程,气体颜色变深,透光率变小,后来平衡正向移动,气体颜色变浅,透光率增大,据此分析。
A、图1现象说明热水中颜色深,升温平衡向逆反应即吸热方向移动,则该反应是正反应气体体积减小的放热反应,A正确;
B、b点开始是压缩注射器的过程,气体颜色变深,透光率变小,B正确;
C、c点平衡正向移动,气体颜色变浅,透光率增大,所以v(正)>v(逆),C正确;
D、c点以后平衡正向移动,气体颜色变浅,透光率增大,又反应放热,导致T(c)<T(d),D错误;
答案选D。

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目