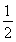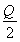题目内容
一定温度下,在2 L密闭容器中加入纳米级Cu2O并通入0.1 mol H2O(g),发生反应:2H2O(g)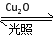 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
时间/min | 20 | 40 | 60 | 80 |
n(O2)/mol | 0.001 0 | 0.001 6 | 0.002 0 | 0.002 0 |
下列说法不正确的是 ( )。
A.前20 min内的平均反应速率v(H2O)=5.0×10-5 mol·L-1·min-1
B.达到平衡时,至少需要从外界吸收能量0.968 kJ
C.增大c(H2O),可以提高水的分解率
D.催化效果与Cu2O颗粒的大小有关
C
【解析】 由题意知,v(H2O)=2v(O2)=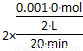 =5.0×10-5 mol·L-1
=5.0×10-5 mol·L-1
·min-1,A正确。热化学方程式表示的含义是2 mol H2O(g)完全分解生成2 mol H2(g)和1 mol O2(g),吸收484 kJ的能量,所以生成O2 0.002 0 mol时,吸收的能量为0.002 0 mol×484 kJ·mol-1=0.968 kJ,正确。C项,由于反应物只有1种,增大c(H2O),相当于压强增大,平衡向气体体积减小的方向移动,所以水的分解率降低,错误。D项,若Cu2O颗粒小,则接触面积大,反应速率快,催化效果好,正确。

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目