题目内容
(13分)某学校设计了一节实验活动课,让学生从废

旧干电池回收碳棒、锌皮、 、
、 、
、 等物质,
等物质,
整个实验过程如下,请回答有关问题。
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是 ,
的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是 。
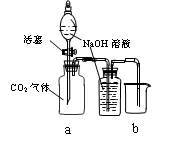
(2) 锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3) 氧化铵、氯化锌的提取、检验和分离。
① 如何从黑色粉末中提取 和
和 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。
② 设计简单的实验证明所得晶体中含有 和
和 [一直
[一直 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
(a) ,(b) ,(c) ,(d) ,(e) ,(f) ,
(4)最后剩余的黑色残渣的主要成分是 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。
,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。

旧干电池回收碳棒、锌皮、
 、
、 、
、 等物质,
等物质,整个实验过程如下,请回答有关问题。
(1)有关干电池的基本构造和工作原理。右图是干电池的
基本构造图。干电池工作时负极上的电极反应式子是 ,

的作用是除去正极上的产物,本身生成Mn2O3,该反应的化学方程式是 。
(2) 锌皮和碳棒的回收。用钳子和剪子开回收的干电池的锌筒,将锌皮和碳棒取出,并用手刷刷洗干净,将电池内的黑色粉末移入小烧杯中。
(3) 氧化铵、氯化锌的提取、检验和分离。
① 如何从黑色粉末中提取
 和
和 等晶体的混合物?写出简要的实验步骤。
等晶体的混合物?写出简要的实验步骤。② 设计简单的实验证明所得晶体中含有
 和
和 [一直
[一直 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。| 实验步骤 | 实验现象 | 实验结论 | 有关离子方程式 |
| (a) | | | |
| (b) | (c) | 说明有 | (d) |
| (e) | (f) | 说明有 | |
(4)最后剩余的黑色残渣的主要成分是
 ,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。
,还有炭黑和有机物等。可用灼烧的方法除去杂质,该实验中需要用到的主要仪器除酒精灯外有(写其中2中即可) 。(1)Zn-2e-=Zn2+;2MnO2+H2= Mn2O3+H2O;(3)①溶解、过滤、蒸发、结晶。②(a)取少量晶体溶于蒸馏水配成溶液。(b)取(a)溶液少许,加入少量NaOH溶液后加热(c)有能使试纸变蓝的气体产生(d) NH4++OH- NH3↑+H2O(e)取(a)溶液少许,加入少量NaOH溶液至生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量(f)两份沉淀都溶,
NH3↑+H2O(e)取(a)溶液少许,加入少量NaOH溶液至生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量(f)两份沉淀都溶,
 NH3↑+H2O(e)取(a)溶液少许,加入少量NaOH溶液至生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量(f)两份沉淀都溶,
NH3↑+H2O(e)取(a)溶液少许,加入少量NaOH溶液至生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量(f)两份沉淀都溶,本题考查实验学生的实验探究能力;(1)在干电池中,锌容易失电子,为电池的负极,电极反应式为:Zn-2e-=Zn2+,正极为NH4Cl得到电子,发生的电极反应为:2NH4++2e-=2NH3↑+H2↑,MnO2被氢气还原为Mn2O3,反应的化学方程式为:2MnO2+H2= Mn2O3+H2O;(3)①混合物中含有不溶物,可向小烧杯中加入一定量的蒸馏水,充分搅拌,然后过滤,将滤液移入蒸发皿中,加热蒸发结晶。②为证明晶体中的离子,可取少量晶体溶于蒸馏水配成溶液。取少许溶液,加入少量NaOH溶液后加热,将湿润的红石蕊试纸放在试管口,可观察到试纸变蓝 有关离子方程式:NH4++OH- NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
 NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
NH3↑+H2O 。由于氢氧化锌是两性氢氧化物,可溶解于氨水,可取原溶液少量于试管中,加入氢氧化钠溶液到生成白色沉淀,将沉淀分成两分,一份加氢氧化钠溶液至过量,另一份加氨水至过量,可见到两份白色沉淀都溶解,说明溶液中含有Zn2+;(4)要通过加热法除去杂质需要用到酒精灯、坩埚、玻璃棒等。
练习册系列答案
相关题目
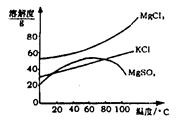
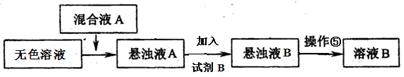

 (B)
(B)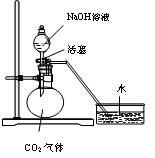
 (D)
(D)