题目内容
实验欲配制6.00 mol/L的H2SO4溶液.现有三种不同浓度的硫酸:①240 mL 1.00 mol/L的硫酸;②150 mL 25.0%的硫酸(ρ=1.18 g/mL);③足量的18.00 mol/L的浓H2SO4.现有三种规格容量瓶:250 mL、500 mL、1000 mL.配制要求:①、②两种硫酸全部用完,不足部分由③补充.试回答:
(1)选用容量瓶的规格是 。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是 。
(1)选用容量瓶的规格是 。
(2)需要18.0 mol·L-1 H2SO4(aq)的体积是 。
(1)1000 mL (2)295 mL
(1)①25.0%的H2SO4溶液的物质的量浓度为:
c2(H2SO4)=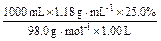 =3.01 mol·L-1
=3.01 mol·L-1
①、②两溶液的体积和约为:
V1+V2=240 mL+150 mL=390 mL
因①、②两溶液的浓度都小于6.00 mol·L-1,所以250 mL的容量瓶不可用。
②设配制500 mL 6.00 mol·L-1H2SO4(aq)需浓H2SO4的体积为x,则
0.500 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+x×10-3 L×18.0 mol·L-1
解得:x=128
因为:128+240+150=518>500
所以,500 mL容量瓶也不能用.
(2)设配制1000 mL 6.00 mol·L-1 H2SO4(aq)需浓H2SO4的体积为y,则:1.000 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+y×10-3 L×18.0 mol·L-1
解得:y=295 mL。
c2(H2SO4)=
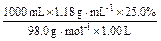 =3.01 mol·L-1
=3.01 mol·L-1①、②两溶液的体积和约为:
V1+V2=240 mL+150 mL=390 mL
因①、②两溶液的浓度都小于6.00 mol·L-1,所以250 mL的容量瓶不可用。
②设配制500 mL 6.00 mol·L-1H2SO4(aq)需浓H2SO4的体积为x,则
0.500 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+x×10-3 L×18.0 mol·L-1
解得:x=128
因为:128+240+150=518>500
所以,500 mL容量瓶也不能用.
(2)设配制1000 mL 6.00 mol·L-1 H2SO4(aq)需浓H2SO4的体积为y,则:1.000 L×6.00 mol·L-1=0.240 L×1.00 mol·L-1+0.150 L×3.01 mol·L-1+y×10-3 L×18.0 mol·L-1
解得:y=295 mL。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目

 、
、 、
、 等物质,
等物质, 和
和 [一直
[一直 是两性氢氧化物且溶解于氨水],并且填写下列实验报告。
是两性氢氧化物且溶解于氨水],并且填写下列实验报告。

 测定剩余固体质量
测定剩余固体质量