题目内容
某学习小组设计以下三个实验探究氯水的组成,请根据下表回答问题.
(1)指出实验①和实验③中的实验现象:a:
(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸造成的,你是否同意这个观点
(3)在分析实验②现象产生的原因时,他们出现了分歧.甲同学认为氯水加入到NaOH溶液中发生了中和反应而使溶液褪色,乙同学认为氯水中含有次氯酸就有漂白性而使溶液褪色.请你设计简单实验证明他们的观点谁正确.
| 实验序号 | 实验方法 | 实验现象 | 结论 |
| ① | 将氯水滴加AgNO3溶液中 | a: 有白色沉淀生成 有白色沉淀生成 |
氯水中含有Cl- |
| ② | 将氯水滴加到含酚酞的NaOH溶液中 | 红色溶液变为无色 | … |
| ③ | 将氯水滴加到Na2CO3溶液中 | b: 有气泡冒出 有气泡冒出 |
氯水中含有H+ |
有白色沉淀生成
有白色沉淀生成
,b:有气泡冒出
有气泡冒出
.(2)有同学认为实验③产生的现象是因为氯水中含有次氯酸造成的,你是否同意这个观点
不同意
不同意
,(填“同意”或“不同意”).理由是:次氯酸酸性比碳酸弱,不能和Na2CO3反应
次氯酸酸性比碳酸弱,不能和Na2CO3反应
.(3)在分析实验②现象产生的原因时,他们出现了分歧.甲同学认为氯水加入到NaOH溶液中发生了中和反应而使溶液褪色,乙同学认为氯水中含有次氯酸就有漂白性而使溶液褪色.请你设计简单实验证明他们的观点谁正确.
向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确
向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确
.分析:(1)氯水中含有Cl-,加入硝酸银生成白色AgCl沉淀;氯水呈酸性,溶液中含有H+,加入Na2CO3溶液,生成二氧化碳气体;
(2)次氯酸酸性比碳酸弱,与碳酸钠不反应;
(3)可根据中和反应与氧化还原反应的异同,在褪色后的溶液中滴加氢氧化钠溶液,根据溶液是否变红判断.
(2)次氯酸酸性比碳酸弱,与碳酸钠不反应;
(3)可根据中和反应与氧化还原反应的异同,在褪色后的溶液中滴加氢氧化钠溶液,根据溶液是否变红判断.
解答:解:氯水中存在Cl2+H2O?H++Cl-+HClO,溶液中存在Cl2、HClO、H+、Cl-等粒子,
(1)将氯水滴加AgNO3溶液中,如有白色沉淀生成,可说明氯水中含有Cl-,发生Ag++Cl-=AgCl↓;将氯水滴加到Na2CO3溶液中,溶液中含有H+,可生成二氧化碳气体,有气泡冒出,
故答案为:有白色沉淀生成;有气泡冒出;
(2)次氯酸酸性比碳酸弱,与碳酸钠不反应,故答案为:不同意;次氯酸酸性比碳酸弱,不能和Na2CO3反应;
(3)中和反应与氧化还原反应的原理不同,如是中和反应,向褪色后的溶液中加NaOH溶液至碱性,溶液可变为红色,如是氧化还原反应,向褪色后的溶液中加NaOH溶液至碱性,溶液不再显红色,根据反应的现象可证明,
故答案为:向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确.
(1)将氯水滴加AgNO3溶液中,如有白色沉淀生成,可说明氯水中含有Cl-,发生Ag++Cl-=AgCl↓;将氯水滴加到Na2CO3溶液中,溶液中含有H+,可生成二氧化碳气体,有气泡冒出,
故答案为:有白色沉淀生成;有气泡冒出;
(2)次氯酸酸性比碳酸弱,与碳酸钠不反应,故答案为:不同意;次氯酸酸性比碳酸弱,不能和Na2CO3反应;
(3)中和反应与氧化还原反应的原理不同,如是中和反应,向褪色后的溶液中加NaOH溶液至碱性,溶液可变为红色,如是氧化还原反应,向褪色后的溶液中加NaOH溶液至碱性,溶液不再显红色,根据反应的现象可证明,
故答案为:向褪色后的溶液中加NaOH溶液至碱性,溶液变红,可证明甲正确,不再显红色,证明乙正确.
点评:本题考查物质含量的测定,侧重于实验现象探究反应本质,根据反应本质揭示反应现象的规律的探究,注重于学生实验能力和探究能力的考查,题目难度中等.

练习册系列答案
相关题目
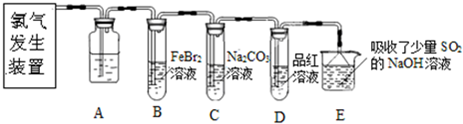
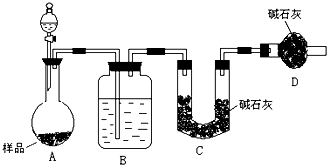 某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.
某校化学研究学习小组设计如下实验方案,测定小苏打样品中纯碱的质量分数.