题目内容
三硫化磷(P4S3)是黄绿色针状晶体,易燃、有毒,分子结构之一如下图所示,已知其燃烧热△H=-3677kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是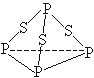
| A.分子中每个原子最外层均达到8电子稳定结构 |
| B.P4S3中硫元素为-2价磷元素为+3价 |
| C.热化学方程式为P4S3( s)+8O2(g)=P4O10(s )+3SO2(g)△H=-3677kJ/mol |
| D.一个P4S3分子中含有三个非极性共价键 |
B
解析试题分析:A、P原子最外层有5个电子,S原子最外层有6个电子,由P4S3的分子结构可知,每个P形成3个共价键,每个S形成2个共价键,分子中每个原子最外层均达到8电子稳定结构,正确;B、由P4S3的分子结构可知,1个P为+3价,其它3个P都是+1价,正价总数为+6,而S为-2价,错误;C、根据燃烧热的概念:1mol可燃物燃烧生成稳定氧化物放出的热量为燃烧热,则P4S3(s)+8O2(g)=P4O10(s)+3SO2(g);△H=-3677kJ/mol,正确;D、由P4S3的分子结构可知, P-P之间的键为非极性键,P-S之间的键为极性键,一个P4S3分子中含有三个非极性共价键,正确。
考点:考查元素化合价的判断、极性键和非极性键的识别及阅读材料接收信息的能力。

练习册系列答案
 优生乐园系列答案
优生乐园系列答案
相关题目
下列分子中,属于含有极性键的非极性分子的是
| A.PCl3 | B.H2S | C.P4 | D.C2H4 |
下列中的物质的分子,键角最小的是
| A.H2O | B.CCl4 | C.NH3 | D.CH4 |
下列说法不正确的是
| A.HCl、HBr、HI的熔点沸点升高与范德华力大小有关 |
| B.H2O的熔点沸点大于H2S的是由于H2O分子之间存在氢键 |
| C.乙醇与水互溶可以用相似相溶原理解释 |
| D.甲烷与水分子间不能形成氢键这种化学 |
下列各分子:①BeCl2 ②PCl3 ③PCl5 ④N2 ⑤白磷P4,分子中所有原子都满足最外层为8电子结构的是
| A.①②④⑤ | B.②④⑤ | C.②③④ | D.①③⑤ |
意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子,N4分子结构与白磷(P4)相同,如图所示,已知断裂1molN-N键吸收167KJ能量,生成1mol 放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )
放出942KJ能量,根据以上信息和数据判断下列说法正确的是( )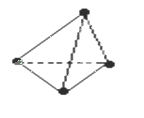
| A.N4分子是一种新型化合物 |
| B.N4和N2互为同素异形体 |
| C.N4比N2稳定 |
| D.1molN4转变为N2将吸收882KJ的能量 |
下列性质中,可以证明某化合物是离子化合物的是
| A.可溶于水 | B.具有较高的熔点 |
| C.其水溶液能导电 | D.其固体不导电,熔融状态能导电 |
某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键是( )
| A.一定是离子键 |
| B.一定是共价键 |
| C.可能是离子键,也可能是共价键 |
| D.以上说法都不正确 |
下列物质变化,只与范德华力有关的是( )
| A.干冰熔化 |
| B.乙酸汽化 |
| C.乙醇与丙酮混溶 |
D. 溶于水 溶于水 |