题目内容
在实验室中,电解500mL某0.03mol·L-1的NaOH溶液,通电一段时间后,溶液的pH从7增加到12时(溶液体积变化忽略)阴极产生多少毫升气体(标准状况),溶液中NaCl浓度为多少?????
0.02mol·L-1
解析:
pH=12时,c(OH-)=0.01mol·L-1,即生成NaOH 0.01mol·L-1×0.5 L=0.005mol
由相当量关系2OH- ~ H2↑ ~ 2NaCl?
2mol 22400ml 2 mol?
0.005mol x y?
x=![]() =56mL?
=56mL?
y=![]() =0.005mol?
=0.005mol?
剩余NaCl 0.03mol·L-1×0.5L-0.005mol=0.015mol-0.005mol=0.01mol??
c(NaCl)=![]() =0.02mol·L-1?
=0.02mol·L-1?

锂被誉为“金属味精”,以LiCoO2为正极材料的锂离子电池已被广泛用作便携式电源。工业上常以β-锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质)为原料来制取金属锂。其中一种工艺流程如下:
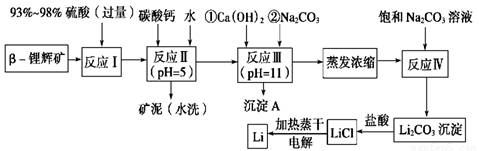
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
|
氢氧化物 |
Fe(OH)3 |
Al(OH)3 |
Mg(OH)2 |
|
开始沉淀pH |
2.7 |
3.7 |
9.6 |
|
完全沉淀pH |
3.7 |
4.7 |
11 |
②Li2CO3在不同温度下的溶解度如下表:
|
温度/℃ |
0 |
10 |
20 |
50 |
75 |
100 |
|
Li2CO3的溶解度/g |
1.539 |
1.406 |
1.329 |
1.181 |
0.866 |
0.728 |
请回答下列问题:
(1)用氧化物形式表示LiAlSi2O6的组成:________________________。
(2)反应Ⅱ加入碳酸钙的作用是_________________________________。
(3)写出反应Ⅲ中生成沉淀A的离子方程式:______________________________________。
(4)反应Ⅳ生成Li2CO3沉淀,写出在实验室中得到Li2CO3沉淀的操作名称___________,洗涤所得Li2CO3沉淀要使用______________ (选填“热水”或“冷水”),你选择的理由是 。
(5)电解熔融氯化锂生产锂时,阳极产生的氯气中会混有少量氧气,原因是:__________________________。

 海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.
海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图.


